Это позволило установить статистически достоверные парные корреляции между интегральной средней концентрацией сизомицина и уровнем остаточного азота (коэффициент корреляции r=0,56), а также между интегральной средней концентрацией и гематокритным числом (r=0,66) (рис. 6-4). Примечательно, что множественный корреляционный анализ индивидуальных значений интегральной средней концентрации по совокупности двух «факторов больного» (уровню остаточного азота и гематокриту) привел к заметному повышению коэффициента корреляции (r=0,74).
Поскольку даже при комплексном учете названных факторов наблюдаемую вариабельность параметра интегральной средней концентрации удалось объяснить лишь на 55%, соответствующие попытки индивидуализации режимов дозирования сизомицина могут быть недостаточно надежными. Вместе с тем, сама по себе возможность прогнозирования фармакокинетического параметра по функциональному состоянию почек и показателю гемодинамики открывает важные перспективы. Более того, очевидно, что комплексный учет этих факторов значительно надежнее учета каждого из них в отдельности.
Возможности рассматриваемого подхода были проанализированы нами при изучении фармакокинетики амикацина после его внутривенной инфузии 16 детям, находившимся в крайне тяжелом (критическом состоянии). Фармакокинетические профили амикацина у обследованных больных также характеризовались выраженной индивидуальной вариабельностью, несмотря на одинаковую тяжесть состояния (критическое) и полученную дозу антибиотика (7,5 мг/кг) (рис. 6-5).
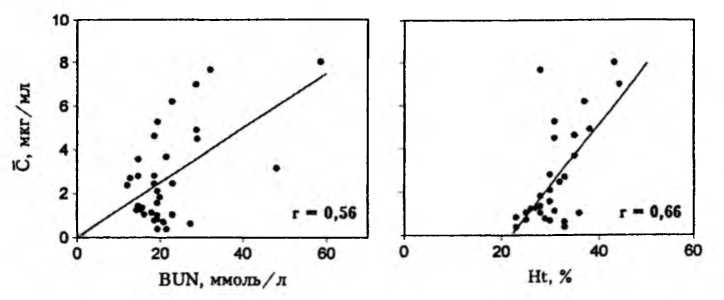
Рис. 6-4. Взаимосвязь интегральной средней концентрации (С) сизомицина, уровня остаточного азота (BUN) и величины гематокрита (Ht) у больных (п=35)
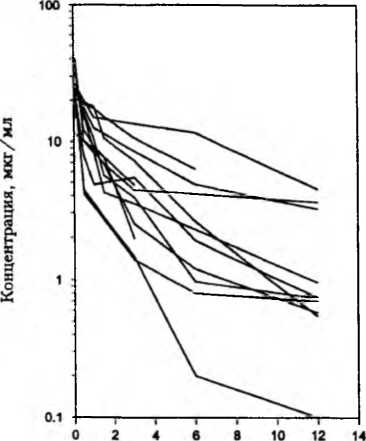
Рис. 6-5. Индивидуальные фармакокинетические профили амикацина в сыворотке крови детей после внутривенной инфузии в дозе 7,5 мг/кг этом колебания уровня антибиотика в сыворотке крови, отмеченные через 5 мин и 6 ч после прекращения инфузии, были соответственно 12- и 60-кратными.
Время после окончания инфузии, час
Выраженность индивидуальных различий в фармакокинетике амикацина отражали и колебания значений параметров общего клиренса Сlт (130,6±20,52 мл/[ч кг]), стационарного объема распределения Vss (582±113,94 мл/кг), среднего времени удержания MRT (5,21±0,94 ч) и периода полувыведения Т1/2(5,025±0,975 ч). Наибольшей индивидуальной вариабельностью характеризовались параметры AUC, Vss и Т1/2, несколько меньшей — MRT, наименьшей — Сlт.
С целью выявления причин отмеченной вариабельности был проведен множественный корреляционный и регрессионный анализ индивидуальных значений общего клиренса, стационарного объема распределения, среднего времени удержания и периода полувыведения по 11 «факторам больного»:
- возрасту (Х1; 1,5-36 мес.),
- массе тела (Х2; 2,3-20 кг),
- количеству лейкоцитов (Х3; 6,6 • 106 /л — 35,2 • 10е /л),
- величине гематокрита (Х4; 26-39%), СОЭ (Х5; 2-67 мм/ч),
- центрального венозного давления (Х6; 60-220 мм водн. ст.),
- парциальному давлению кислорода (Х7; 42-83 мм рт.ст.) и углекислого газа в крови (Х8; 24-50 мм рт.ст.),
- уровню креатинина (Х9; 50-116 мкмоль/л) и мочевины (Х10; 3,33-9,99 ммоль/л) в сыворотке, а также ее осмолярности (Х11; 247-320 мосм/кг).
Коэффициент множественной корреляции между общим клиренсом амикацина и 8 «факторами больного» (масса тела, количество лейкоцитов, скорость оседания эритроцитов, величина гематокрита, содержание в сыворотке креатинина и мочевины, парциальное давление кислорода и углекислого газа в крови) оказался наиболее высоким (r=0,97). Меньших значений достигали коэффициенты корреляций между средним временем удержания антибиотика и 2 факторами (возраст и центральное венозное давление) — 0,76 и между стационарным объемом распределения и 4 факторами (возраст, СОЭ, содержание в сыворотке мочевины, парциальное давление углекислого газа в крови) — 0,74. В результате отбора статистически значимых «факторов больного», оказывающих влияние на общий клиренс амикацина, было получено соответствующее уравнение регрессии:
Сlт= 1948-26,4X2-4,6X3- 1295 Х4 — 11,1 Х5 -6,8 X7-25,3 X8-9, 8X9-19,1 Х10
Прогнозирование индивидуальных значений общего клиренса амикацина по этому уравнению характеризовалось не только высокой точностью, но и минимальной смещенностью. Как видно на рис. 6-6, индивидуальные значения общего клиренса, рассчитанные по фармакокинетическим данным и прогнозированные по “факторам больного», практически совпадают. Рассеяние точек вокруг “нулевой линии” (биссектрисы угла) достаточно равномерно. Установленная корреляция удовлетворяет, по меньшей мере, 94% наблюдаемой вариабельности значений общего клиренса амикацина, а, следовательно, позволяет прогнозировать индивидуальные значения этого параметра по упомянутым 8 «факторам больного» с помощью приведенного выше уравнения, а затем индивидуальную дозу амикацина (Di) по известной формуле (Соловьев В.Н., Фирсов А.А. и соавт., 1980):
![Рис. 6-6. Взаимосвязь индивидуальных значений общего клиренса амикацина [мл/(ч кг)], рассчитанных по фармакокинетическим данным (Сlт) и по «факторам больного» (Сlт) Рис. 6-6. Взаимосвязь индивидуальных значений общего клиренса амикацина [мл/(ч кг)], рассчитанных по фармакокинетическим данным (Сlт) и по «факторам больного» (Сlт)](https://auno.kz/wp-content/uploads/2015/04/1-10.jpg)
Рис. 6-6. Взаимосвязь индивидуальных значений общего клиренса амикацина [мл/(ч кг)], рассчитанных по фармакокинетическим данным (Сlт) и по «факторам больного» (Сlт)
где Di и Dp — соответственно индивидуальная и стандартная (7,5 мг/кг) дозы, а Сli и Clp — индивидуальное и среднее (131 мл/[ч-кг]) значения клиренса, установленные в настоящем исследовании.
Предложенный подход значительно надежней попыток прогнозирования фармакокинетических параметров по какому-либо одному «фактору больного», поскольку позволяет полнее учитывать индивидуальные особенности больного. Конечно, по мере нормализации состояния больного взаимосвязь между «факторами больного» и фармакокинетическим параметром будет неизбежно утрачена. Тем не менее, возможность расчета индивидуального режима дозирования по «факторам больного» имеет особое значение на начальном этапе лечения, когда необходимо быстро определить оптимальную дозу препарата и предотвратить возможность развития тяжелых токсических реакций. Дальнейшая индивидуализация режима дозирования может быть обеспечена путем определения концентрации аминогликозидов в крови (фармакокинетический мониторинг). Оба подхода не следует противопоставлять друг другу, поскольку они представляют собой два последовательных этапа индивидуализации дозирования.
Установление корреляции между фармакокинетическими параметрами и характеристиками состояния детей подчеркивает принципиальную возможность опосредованной индивидуализации дозирования аминогликозидов не только при хронических нарушениях метаболизма или функций выделения (например, при хронической почечной недостаточности), но и при транзиторных изменениях таких функций у детей.
Следует подчеркнуть, что особенности фармакокинетики сизомицина и амикацина при пневмонии у детей раннего возраста, обусловленные крайней тяжестью состояния, имеют, по-видимому, общее значение.
Можно предположить, что подобные фармакокинетические ситуации имеют место и при использовании других антибиотических препаратов в периоды крайней тяжести больных. Это свидетельствует о необходимом пересмотре дозировок лекарственных средств в критических состояниях.
Литература
- Белоусов Ю.Б., Омельяновский В.В. Клиническая фармакология болезней органов дыхания. Руководство для врачей. М.: Универсум Паблишинг. 1996. — 176 с.
- Иоников В.Е., Константинова Т.Д., Ленкова Н.И., Аргеткина И.Н. Фармакоэкономические аспекты антибактериальной терапии пневмоний. // Инфекции и антимикробная терапия. — 1999. — №2. — С. 44-46.
- Каганов С.Ю., Панкова Г.Ф. Антибиотикотерапия в современной пульмонологической клинике. /В кн.: Пневмонии у детей. Под ред. С.Ю.Каганова и Ю.Е.Вельтищева. М.: Медицина, 1995. — С. 293-270.
- Самсыгина Г.А. Особенности антибиотикотерапии в педиатрии. Клиническая антимикробная химиотерапия. 1999. — №1(2). — С. 68-70
- Середа Е.В., Катосова Л.К., Платонова М.М. Перед трудным выбором. //Медицина для всех. — 1998. — №2(8). — С. 17-13
- Соловьев В.Н., Фирсов А.А., Филов В.А. Фармакокинетика (руководство). -М: Медицина. 1980. — 423 с.
- Страчунский Л.С., Козлов С.Н. Антибиотики: клиническая
- фармакология. -Смоленск, 1994.-208 с.
- Яковлев С.В. Клиническая химиотерапия бактериальных инфекций. — М: НЬЮДИАМЕД-АО, 1997. — 148 с.
- Яковлев С.В. Обоснование режима дозирования имипенема при госпитальных инфекциях. // Инфекции и антимикробная терапия. — 2000. — №2(3). — С. 90 88.
- AmakerR.D., DiPiro J.T., Bhatia J. Pharmacokinetics of vancomycin in critically ill infants undergoing extracorporeal membrane oxygenation. // Antimicrob Agents Chemother. -1996. — 40(5):1139-42.
- Ambrose P.G., Owens R.S. New antibiotics in pulmonary and critical care medicine: focus on advanced generation quinolones and cephalosporines. // Sem Resp Crit Care Med. -2000. -21(1): 19-32.
- Bass K.D., Larkin S.E., Paap C., Haase G.M. Pharmacokinetics of once-daily gentamicin dosing in pediatric patients.//J Pediatr Surg 1998; 33(7). p.1104-7
- Chan R., Hemeryck, О Regan M., Hart W. et al. Ora! versus intravenous antibiotics for community acquired lower respiratory tract infection in a general hospital: open, randomized controlled trial. // Brit Med J. — 1995. — 310. — p. 1360-2.
- Chuck S.K., Raber S.R., Rodvold K.A., Areff D. National survey of extended-interval aminoglycoside dosing. // Clin Infect Dis. — 2000. — 30(3). — p. 433-9.
- Cohen R, Collart L., Prober C.G., Fischer A.F., Blaschke T.F. Gentamicin pharmacokinetics in neonates undergoing extracorporal membrane oxygenation. // Pediatr Infect Dis J. -1990.- 9(8).-p.562 6.
- de Hoog M., Schoemaker R.C., Mouton J.W., van den Anker J.N. Vancomycin population pharmacokinetics in neonates. // Clin Pharmacol Ther. — 2000. — 67(4). — p. 360-7.
- Fanos V., Cataldi L. Antibacterial-induced nephrotoxicity in the newborn. // Drug Saf. -1999.-20(3).-p. 245-67.
- Garraffo R. Optimal adaptive control of pharmacodynamic effects with aminoglycoside antibiotics: a required approach for the future. // Int J Biomed Comput. — 1994. — 36(1— 2). — p. 43-57.
- Gous A.G., Dance M.D., Lipman J. et al. Changes in vancomycin pharmacokinetics in critically ill infants. //Anaesth Intensive Care. — 1995. — 23(6). — p. 678-82.
- Grimsley C., Thomson A.H. Pharmacokinetics and dose requirements of vancomycin in neonates. //Arch Dis Child Fetal Neonatal Ed. — 1999. — 81(3) F221-7
- Hoey L.L., Tschida S.J., Rotschafer J.C. et al. Wide variation in single, daily-dose aminoglycoside pharmacokinetics in patients with bum injuries. // J Bum Care Rehabil.- 1997,- 18(2).-p. 116-24.
- Hoppe J.E. Rational prescribing of antibacterials in hospitalised children. // Pharmacoeconomics. — 1996.- 10(6).-p. 575-93.
- Kollef M.N. Ventilator-associated pneumonia: the importance of initial empirical antibiotic selection. // Infect Med. — 2000. — 17(4). — p. 278-83.
- Konrad F., Wagner R., Neumeister B. et al. Studies on drug monitoring in thrice and once daily treatment with aminoglycosides. // intensive Care Med. 1993. — 19(4). — p. 215-20.
- Langlass T.M., Mickle T.R. Standard gentamicin dosage regimen in neonates. // Am J Health Syst Pharm. — 1999. — 1. — 56(5). — p. 440-3.
- Langtry H.D., Balfour J.A. Azithromycin. A review of its use in paediatric infectious diseases. // Drugs. — 1998. — 56(2). — p. 273-97.
- Lewis D.A., Reeves D.S. Antibiotics at the extremes of age: choices and constraints. // J Antimicrob Chemother. — 1994. — 34 Suppl A. — p. 11-8.
- LinC.C., Radwanski E.,Korduba C. etal. Pharmacokinetics of intramuscularly administered isepamicin in man. // Chemotherapy. — 1997. — 43(2). — p. 86-93.
- Long S.S., Pickering L.K ., Prober C.G. (Eds.) Principles and Practice of Pediatric Infectious Diseases. — New York, 1997. — p. 1689
- Miles M.V., Li L., Lakkis H. et al. Special considerations for monitoring vancomycin concentrations in pediatric patients. // Ther Drug Monit. — 1997. 19(3). — p. 265 70.
- Nahata M.C. Advances in paediatric pharmacotherapy. // J Clin Pharm Ther. 1992. -17(3). -p. 141-6.
- New H.C., Young L.S., Zinner S.H., Acar J.F. (Eds.) New Macrolides, Azalides and Streptogramines in Clinical Practice. — New York, 1995. — p. 258.
- Paap C.M., Nahata M.C. Clinical pharmacokinetics of antibacterial drugs in neonates. // Clin Pharmacokinet. — 1990. — 19(4). — p. 280-318 .
- Rodvold К.Л., Everett J.A., Pryka R.D., Kraus D.M. Pharmacokinetics and administration regimens of vancomycin in neonates, infants and children. // Clin Pharmacokinet. — 1997 33(1). — p. 32-51.
- Rodvold K.A., Gentry C.A., Plank G.S. et al. Bayesian forecasting of serum vancomycin concentrations in neonates and infants. // Ther Drug Monit. 1995. 17(3). — p. 239-46.
- Rosario М.С., Thomson A.H., Jodrell D.I. et al. Population pharmacokinetics of gentamicin in patients with cancer. // Br J Clin Pharmacol. — 1998. — 46(3). p. 229-36.
- Routledge P.A. Pharmacokinetics in children. // J Antimicrob Chemother. 1994. — 34 Suppl A. — p. 19-24.
- Sanchez-Alcaraz A., Vargas A., Quintana M.B. et al. Therapeutic drug monitoring of tobramycin: once-daily versus twice-daily dosage schedules. // J Clin Pharm Ther. -1998.-23(5).-p. 367-73
- Thoroddsen E. Measuring antibiotic levels in otitis media. // Ear Nose Throat J. — 1998. -77(6 Suppl). -p. 13-5.
- Tod M., Padoin C., Petitjean O. Clinical pharmacokinetics and pharmacodynamics of isepamicin. // Clin Pharmacokinet. — 2000. — 38(3). — p. 205-23.
- Toyonaga Y. Pharmacokinetics of antibiotics in children.// Acta Paediatr Jpn. 1997. -39(1). -p. 114-23.
- Vogel F. Sequential therapy in the hospital management of lower respiratory infections. // Am J Med. — 1995. — 99(6b). — p. 19-14.
- Wade W.E., McCall C.Y. Pharmacist-managed aminoglycoside therapy in combination with a beta-lactam agent in the treatment of nosocomial pneumonia in critically ill patients. // Pharmacotherapy. — 1995. — 15(2). -p. 216-9.
- Winnie G.B., Cooper J. A., Witson J. etal. Comparison of 6 and 8 hourly tobramycin dosing intervals in treatment of pulmonary exacerbations in cystic fibrosis patients. // Pediatr Infect Dis J. — 1991.-10(5).-p. 381-6.
- Yasuhara M., Iga T., Zenda H. et al. Population pharmacokinetics of vancomycin in Japanese pediatric patients. // Ther Drug Monit. — 1998. — 20(6). — p. 612-8,
- Yurdakok M. Antibiotic use in neonatal sepsis. // Turk J Pediatr. — 1998. 40(1). — p. 17-33.
