Важной проблемой антибиотикотерапии является выбор оптимальной дозы препарата. Однако проведение фармакокинетических исследований и использование их результатов для расчетов режимов дозирования представляет собой серьезную проблему, особенно в педиатрической практике, т.к. у детей индивидуальная вариабельность фармакокинетики значительно выше, чем у взрослых [Gous A.G. et al., 1995; Grimsley C., Thomson A.H., 1999; Miles M.V. et al., 1997; Tod M., Padoin C., Petitjean O., 2000]. Поэтому при введении препарата в одинаковой дозе (в мг/кг) его концентрация в крови у одного ребенка может быть во много раз выше, чем у другого. Такие непредсказуемые колебания концентраций могут быть чреваты недостаточной эффективностью или небезопасностью. Особенно важно обеспечить оптимальный режим введения препаратов, имеющих малый диапазон между терапевтической и токсической концентрациями.
Концентрацию одних антибиотиков в крови необходимо определять лишь в отдельных случаях. Например, при печеночной недостаточности необходим мониторинг концентраций ванкомицина и хлорамфеникола [Fanos V., Cataldi L, 1999; Rodvold К.A. et al., 1997; Tod M., Padoin C., Petitjean 0., 2000]. Динамическое наблюдение за концентрацией ванкомицина позволит предупредить токсическое поражение почек и органа слуха, развитие тромбофлебита и дерматоза. Максимальная концентрация ванкомицина должна составлять 20-40 мкг/мл, минимальная — 5-10 мкг/мл. Терапевтические концентрации хлорамфеникола колеблются от 5 мкг/мл (минимальная) до 10-25 мкг/мл (максимальная). Превышение терапевтической концентрации может привести к угнетению костномозгового кроветворения вплоть до панцитопении, поражению печени, желудочно-кишечным расстройствам, нейропатии, ретинопатии.
Возможность развития серьезных побочных эффектов, таких, как ото-и нефротоксичность, нервно-мышечная блокада, требует терапевтического мониторинга антибиотиков-аминогликозидов, особенно у детей раннего возраста [Fanos V., Cataldi L., 1999]. Для гентамицина, тобрамицина, сизомицина, нетилмицина значения максимальной (пиковой) концентрации должны быть не более 10 мкг/мл, минимальной (перед введением очередной дозы) — не более 2 мкг/мл, для амикацина эти концентрации составляют 30 мкг/мл и 10 мкг/мл, для изепамици-на-40 мкг/мл и 5 мкг/мл соответственно [Страчунский Л.С., Козлове.Н., 1994; Tod М., Padoin С., Petitjean О., 2000].
Наши исследования, проведенные совместно с профессором А.А.Фирсовым, показали, что у детей раннего возраста, больных острой пневмонией, фармакокинетические профили этих препаратов очень вариабельны. При этом, несмотря на одинаковую дозу (1 мг/кг), вводимую при 30-минутной инфузии, максимальный уровень сизомицина в сыворотке крови 20 детей варьировал в 20-кратном диапазоне (от 2,4 до 48,3 мкг/мл). Выраженную вариабельность фармакокинетики сизомицина отражали большие значения доверительных интервалов концентраций (рис. 6-1а), а также коэффициенты вариации фармакокинетических параметров (рис. 6-2). Как видно на рис. 6-2, интегральная средняя концентрация, общий клиренс, кинетический объем распределения характеризовались значительно большей вариабельностью, чем период полувыведения. Было отмечено, что при разделении больных на группы в зависимости от тяжести состояния уровень сизомицина у детей, находившихся в крайне тяжелом (критическом) состоянии, был значительно выше на всем протяжении интервала дозирования, причем даже средняя величина максимальной концентрации выходила за допустимые пределы (рис. 6-16). Так, у больных в тяжелом состоянии максимальная концентрация антибиотика (через 5 мин после прекращения инфузии) в среднем составляла 3,34±0,97 мкг/мл, а к концу интервала дозирования (8 ч) — 0,13±0,045 мкг/мл, у больных в критическом состоянии — соответственно 11,52±4,08 мкг/мл и 0,38±0,24 мкг/мл. Выявленные различия в фармакокинетике аминогликозидов свидетельствуют о риске создания потенциально токсических концентраций этих антибиотиков у больных, находящихся в критическом состоянии. Поэтому увеличение дозы аминогликозидов у крайне тяжелых больных не оправдано.
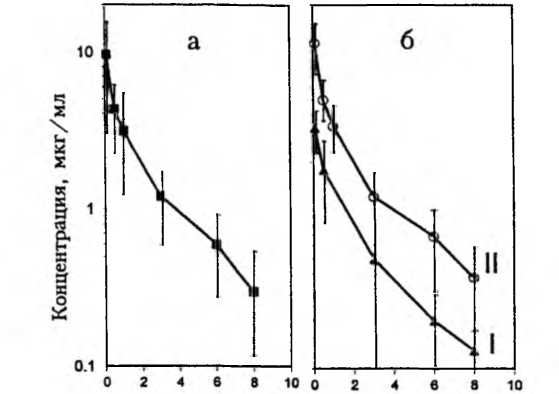
Рис. 6-1. Усредненные фармакокинетические профили сизомицина в сыворотке крови при внутривенном введении: а — все больные (п=20); б — больные в тяжелом (I, п=4) и критическом (II, п=16) состоянии
Время после окончания инфузии, ч
Описанные различия в фармакокинетических профилях сизомицина у больных, находившихся в тяжелом и критическом состоянии, нашли свое отражение в фармакокинетических параметрах. Интегральная средняя концентрация сизомицина у детей в критическом состоянии была в 2,5 раза выше, чем у больных в тяжелом состоянии (1,99±0,86 и 0,76±0,89 мкг/мл соответственно, Р>0,95) (рис. 6-3).
Выявленные различия в интегральной средней концентрации сизомицина у больных с различной тяжестью состояния были обусловлены различиями в значениях других фармакокинетических параметров: общего клиренса и кинетического объема распределения антибиотика. У больных, находившихся в крайне тяжелом состоянии, общий клиренс и кинетический объем распределения сизомицина были ниже (в 2,4 и 2,8 раза соответственно), чем у детей, находившихся в тяжелом состоянии. Примечательно, что тяжесть состояния детей практически не влияла на продолжительность периода полувыведения сизомицина (2,65±1,65 и 2,78+2,54 ч соответственно), что обусловлено однонаправленными изменениями клиренса и объема распределения.
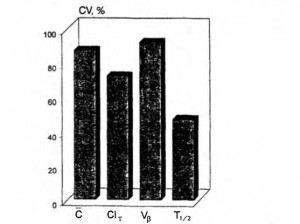
Рис. 6-2. Коэффициенты вариации фармакокинетических параметров сизомицина у всех обследованных больных (п=20)
Здесь и на рис. 3:
- С-интегральная средняя концентрация;
- clT общий клиренс;
- Vβ — кинетический объем распределения;
- Т 1/2 — период полувыведения

Рис. 6-3. Средние значения фармакокинетических параметров сизомицина при его внутреннем введении и соответствующие доверительные интервалы (Р>0,95) у больных в тяжелом (I) и критическом (II) состояниях
Отмеченное уменьшение кинетического объема распределения у крайне тяжелых больных, по-видимому, связано с уменьшением у них количества внеклеточной жидкости, объема плазмы, что характерно для детей с выраженным токсикозом и эксикозом.
В связи с тем, что общий клиренс сизомицина у больных второй группы был ниже, чем у детей первой группы, тактика коррекции режима дозирования у больных, находящихся в критическом состоянии должна предусматривать снижение «скорости дозирования» (отношение дозы к интервалу дозирования). При этом, поскольку увеличение тяжести состояния сопровождалось снижением объема распределения, а не периода полувыведения, требуемое снижение скорости дозирования должно обеспечиваться снижением дозы до 0,75 мг/кг при сохранении 8-часового интервала дозирования.
По-видимому, подобная коррекция стандартной методики дозирования сизомицина с учетом различий в тяжести состояния детей позволит повысить эффективность и безопасность применения аминогликозидов. Вместе с тем, и после распределения больных на две группы индивидуальная вариабельность фармакокинетики аминогликозида внутри каждой из них оставалась весьма значительной, хотя была выражена в меньшей степени, чем для обследованного контингента больных в целом. В этой связи мы попытались объяснить вариабельность фармакокинетики сизомицина влиянием «факторов больного», в частности, функциональным состоянием почек (уровень остаточного азота, мочевины, креатинина в сыворотке крови), состоянием гемодинамики и гомеостаза (центральное венозное давление, гематокрит, содержание гемоглобина, показатели парциального давления кислорода и углекислого газа в крови).
Для проверки этого предположения были проанализированы результаты лабораторного и фармакокинетического обследования 35 детей, которые получали сизомицин в разовой дозе 1 мг/кг каждые 8 ч парентерально. С этой целью, одновременно для больных обеих групп, был проведен корреляционный и регрессионный анализ индивидуальных значений интегральной средней концентрации, общего клиренса, кинетического объема распределения, периода полувыведения сизомицина по таким «факторам больного», как уровень остаточного азота в сыворотке крови, содержание гемоглобина, показатели гематокрита, центрального венозного давления.
