Литий
Наиболее изученным средством аугментации при ТРД является карбонат лития. Даже небольшие дозы лития (концентрация в крови 0,4-0,6 ммоль/л) в течение нескольких дней могут привести к улучшению в состоянии больного. Курс терапии не превышает 4 недель. Комбинировать антидепрессанты с литием нужно осторожно, поскольку повышенные дозировки могут привести к развитию нейротоксических реакций (миоклония, атаксия, возбуждение, спутанность), а при сочетании с L-триптофаном (т.н. „ньюкаслский» или „серотониновый» коктейль) — к серотониновому неврологическому синдрому. Кроме того, нежелательные явления при терапии литием включают кардиотоксичность, нефротоксичность, тиреотоксичность и прибавку веса. Из-за узкого терапевтического диапазона требуется периодический контроль концентрации лития в крови. Считается, что литий может менять рецепторную чувствительность постсинаптической мембраны. В 7 рандомизированных плацебо-контролируемых исследованиях в качестве добавочного средства при терапии трициклическими антидепрессантами (ТЦА) использовался литий (HeningerG. R. и соавт., 1983; Kantor D. и соавт., 1986; Zusky Р. М. и соавт., 1988; Schopf J. и соавт., 1989; Stein G. и Bemadt М., 1993; Joffe R.T. и соавт., 1993; Nierenberg A. A., Papakostas G. I. и соавт., 2003). В 3 из них показано преимущество лития над плацебо, в 4 — равная эффективность. В мета-анализе Bauer М., Dopfmer S. (1999), в который вошло 7 исследований, показано, что аугментация антидепрессантов литием более эффективна, чем в аугментация плацебо. Во всех этих исследованиях в качестве антидепрессантов применялись ТЦА. В настоящий момент нет достаточного числа доказательных данных об эффективности аугментации литием антидепрессантов нового поколения (СИОЗС, селективные ингибиторы обратного захвата серотонина и норадреналина [СИОЗСН], бупропион). Кроме того, опубликовано крайне мало сведений о сравнении лития с другими средствами аугментации. В двух идентичных по дизайну рандомизированных двойных слепых исследованиях Fava М. и соавт. (1994,2002) сравнивалось несколько стратегий лечения пациентов с ТРД, не отреагировавших на флуоксетин: аугментация литием, аугментация дезипрамином и продолжение монотерапии флуоксетином с повышением дозы. Сводные результаты этих исследований показали, что при повышении дозы СИОЗС происходит большая редукция депрессивной симптоматики, чем при комбинированной терапии с литием или дезипрамином. Парис. 3 представлены результаты мета-анализа 10 рандомизированных плацебо-контролируемых исследований аугментации антидепрессантов литием, выполненного Crossley N.A., Bauer М. (2007).
Авторами показана достоверная эффективность данного метода аугментации при ТРД.
Миртазапин и миансерин
Оба препарата являются антагонистами серотониновых рецепторов 2-го и 3-го типов, а также альфа-2-адренергических ауторецепторов. В 4 исследованиях оценивалась эффективность комбинирования СИОЗС с миртазапином или миансерином у пациентов с большой депрессией (большой депрессивный эпизод [БДЭ] по критериям DSM-IV) (Maes М., Libbrecht I. и соавт., 1999; Ferreri М., Lavergne Е и соавт., 2001; Licht R. W. и Qvitzau S., 2002; Carpenter L. L. и соавт., 2002). В 3-х из 4-х исследований показано, что комбинированная терапия с этими препаратами превосходит по эффективности плацебо. Преимуществом этих препаратов является седативный эффект, который оказывается крайне полезным при бессоннице, недостатком — повышенный риск антигистаминовых побочных эффектов (прибавка веса и избыточная седация), антихолинергических побочных эффектов (снижение концентрации внимания и спутанность), а также небольшой риск агранулоцитоза.
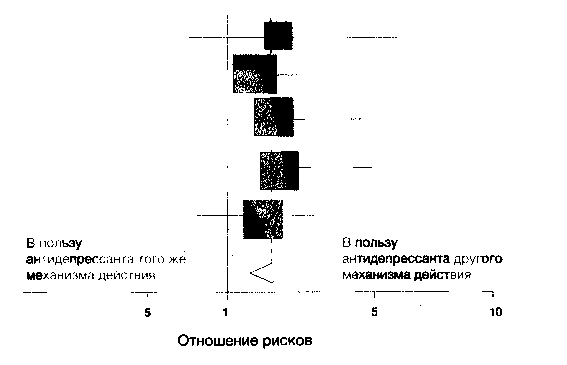
Рис. 2. Мета-анализ исследований замены антидепрессанта при неэффективности 1 курса терапии СИОЗС (адаптировано из публикации Papakostas G. I. и соавт., 2008).
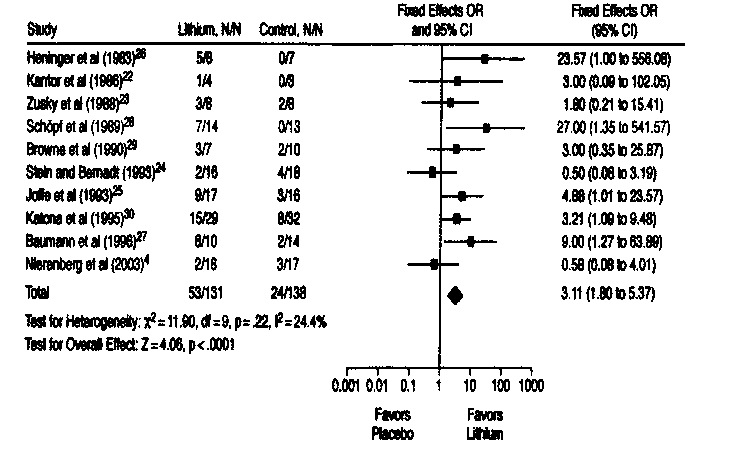
Рис. 3. Результаты мета-анализа 10 рандомизированных плацебо-контролируемых исследований аугментации антидепрессантов литием (Crossley N. А. и Bauer М., 2007)
Примечание:
- Fixed Effects OR — отношение шансов фиксированных эффектов;
- 95% CI = доверительный интервал 95%;
- Favors Placebo — в пользу плацебо;
- Favors Lithium — в пользу лития.
Примечание: - Fixed Effects OR — отношение шансов фиксированных эффектов;
- 95% CI = доверительный интервал 95%;
- Favors Placebo — в пользу плацебо;
- Favors Lithium — в пользу лития.
Пиндолол
Пиндолол — β-адреноблокатор, являющийся также антагонистом серотониновых рецепторов типа 1А. В 3 рандомизированных двойных слепых плацебо-контролируемых исследованиях оценивалась эффективность пиндолола у пациентов с депрессией, не реагирующих на антидепрессанты (Maes М. и соавт., 1996; Maes М., Libbrecht I. и соавт., 1999; Рёгег V. и соавт., 1999). В рандомизированное двойное слепое плацебо-контролируемое исследование Perry Е. В., Berman R. М. и соавт. (2004) включались пациенты с ТРД в рамках большого депрессивного расстройства (БДР) по критериям DSM-IV. В двух исследованиях, проведенных в Нидерландах, показано, что пиндолол более эффективен, чем плацебо (Maes М. и соавт., 1996; Maes M., Libbrecht I. и соавт., 1999). Эти два исследования были методически несовершенны — в них включались как пациенты с резистентностью, так и пациенты, никогда прежде не получавшие антидепрессанты. В 2 других исследованиях включались пациенты с ТРД. В них не показано преимущество пиндолола над плацебо. В мета-анализе всех 4 исследований показано преимущество пиндолола над плацебо на ранних этапах лечения и отсутствие такового после 2-й недели терапии (Ballesteros J., Callado L. Е, 2004). Выявленные побочные эффекты пиндолола включали сонливость, тошноту, брадикардию, ортостатическую гипотензию, потливость и сухость во рту.
Омега-3 полиненасыщенные жирные кислоты
В 3 рандомизированных двойных слепых плацебо-контролируемых исследованиях в качестве добавочных средств при ТРД применялись омега-3 полиненасыщенные жирные кислоты, а именно эйкозапентаеновая и докозагексаеновая (Peet М., Horrobin D. Е, 2002; Nemets В., Stahl Z. и соавт., 2002; Su К. Р., Huang S. Y. и соавт., 2003). В исследования
Nemets В. и соавт. (2002) и Su К. Р. и соавт. (2003) включались пациенты с ТРД в рамках рекуррентной депрессии или БДР по критериям DSM-IV. В исследование Peet М. и соавт. (2002) включались пациенты с ТРД без дополнительного нозологического уточнения. В этих работах показана эффективность данного метода аугментации. Помимо хорошей переносимости эссенциальные жирные кислоты отличаются другими преимуществами, в том числе снижением риска сердечно-сосудистых заболеваний. В работе Peet М. (2002) сравнивались различные дозировки жирных кислот (1, 2 и 4 г/сут), наиболее эффективной признана доза, составляющая 1 г/сут.
Трийодтиронин
Трийодтиронин — это гормон щитовидной железы, применяемый при ТРД в дозе 25-50 мг/сут в течение 1 месяца. Эффект обычно наступает в первые дни лечения. Препарат мешает связыванию антидепрессантов с белками крови и повышает их свободную фракцию в крови. В процессе терапии нередко развиваются явления гипертиреоидизма (головные боли, гипергидроз, тахикардия, тремор, аритмия, боли в сердце), возможно повышение артериального давления (АД). В 2 рандомизированных контролируемых исследованиях оценивалась эффективность трийодтиронина (Сорреп А. и соавт., 1972; Gitlin M.J. и соавт., 1987) как добавочного средства в терапии депрессии. В исследования включались пациенты с БДР, не реагирующие на ТЦА. В исследовании Сорреп А. (1972) показано преимущество трийодтиронина над плацебо; в исследовании Gitlin M.J. (1987) этого различия не обнаружено. Исследования имели относительно короткую продолжительность (2 недели). В мета-анализе 3 исследований ТЦА с трийодтиронином (Aronson R. и соавт., 1996) не обнаружено клинически значимого превосходства трийодтиронина над плацебо. Таким образом, для доказательства эффективности такого метода терапии ТРД необходимо проведение дополнительных исследований и прицельное изучение безопасности его долгосрочного воздействия на плотность костной ткани у женщин.
Психостимуляторы
Метилфенидат — психостимулятор, применяющийся для лечения синдрома дефицита внимания и гиперактивности (СДВГ). Метилфенидат применяется в дозе 20-30 мг/сут утром и днем в дополнение к основной терапии антидепрессантом. Эффект обычно наступает в первые дни терапии, курс 2-3 недели. Метилфенидат повышает содержание ТЦА в плазме крови. Среди побочных явлений этого препарата возможно повышение артериального давления и усиление психотической (галлюцинаторно-бредовой симптоматики). Метилфенидат не является объектом химической зависимости или злоупотребления. В 2 рандомизированных двойных слепых плацебо-контролируемых исследованиях в качестве добавочного средства при ТРД применялся метилфенидат с лекарственной формой OROS (осмотическая система высвобождения препарата). Ни в одном из этих исследований не показано глобального преимущества метилфенидата над плацебо (Patkar A. A., Masand Р. S., 2006; Ravindran А. V., Kennedy S. Н., 2008). Однако замечено, что апатия и утомляемость в большей степени редуцировались в группах метилфенидата. Помимо этого, нужно принять во внимание эффективность метилфенидата при СДВГ, который является распространенным коморбидным расстройством при депрессии у подростков. Модафинил — современный психостимулятор „мягкого действия» с не до конца изученным механизмом. Известно, что модафинил усиливает выброс в синаптическую щель дофамина и норадреналина, а также повышает уровень гистамина в гипоталамусе. Модафинил зарегистрирован FDA в качестве средства лечения нарколепсии, расстройств цикла сон-бодрствования у здоровых людей, а также дневной сонливости при синдроме обструктивного апноэ во сне. В обзоре Candy В. и соавт. (2009), указано, что в двух крупных плацебо-контролируемых исследованиях аугментации антидепрессантов модафинилом при ТРД в течение 6-8 недель (в общей сложности 411 пациентов) не обнаружено значимого преимущества модафинила над плацебо. В отношении других психостимуляторов (пемолин, метиламфетамин, декстроамфетамин) в литературе пока не опубликовано обнадеживающих данных.
Ламотриджин
Ламотриджин — это противосудорожное средство, используемое в комплексном лечении парциальной эпилепсии, а также как средство длительной нормотимической терапии биполярного аффективного расстройства II типа. В двух рандомизированных контролируемых исследованиях ламотриджина в качестве средства аугментации при ТРД не обнаружено его преимуществ над плацебо (Barbosa L. и соавт., 2003; Santos М. А. и соавт., 2008). Наращивание дозы ламотриджина в начале терапии требует длительной титрации из-за риска развития синдрома Стивенса-Джонсона.
Атипичные антипсихотики
Аугментация атипичными антипсихотиками в настоящее время является достаточно исследованным методом терапии пациентов с депрессией, не реагирующих на антидепрессанты. В то же время, при назначении атипичных антипсихотиков пациентам с депрессией необходимо тщательно взвешивать риск развития побочных эффектов. Нежелательные явления, связанные с атипичными антипсихотиками, включают гиперпролактинемию, метаболические нарушения (увеличение массы тела, дислипидемия, нарушение углеводного обмена), лейкопению, седацию и сонливость, антихолинергические и экстрапирамидные побочные эффекты. Также существует некоторый риск развития поздней дискинезии и злокачественного нейролептического синдрома.
В 2007 году Papakostas G. I. провел мета-анализ 10 рандомизированных двойных слепых плацебо-контролируемых исследований, в которых изучались эффективность и переносимость аугментации стандартной антидепрессивной терапии атипичными антипсихотиками при лечении ТРД. Во включенных в мета-анализ исследованиях наблюдалось 1500 пациентов, получавших рисперидон, оланзапин, кветиапин или плацебо в дополнение к антидепрессантам (преимущественно СИОЗС). Частота ремиссии при аугментации атипичными антипсихотиками была достаточно высокой: приблизительно 47 %, в сравнении с 22 % в группах плацебо. Обнаружено, что при использовании атипичных антипсихотиков частота ремиссии возрастает, однако препараты, используемые для аугментации, обнаружили худшую переносимость, чем плацебо. Результаты этого мета-анализа приведены на рис. 4.
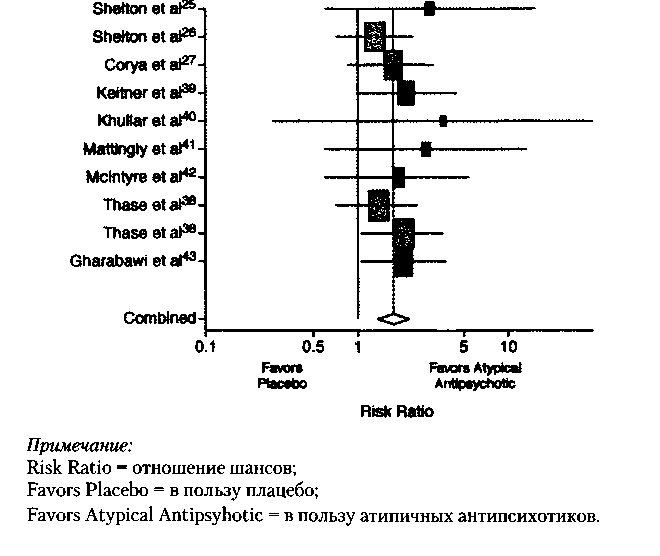
Рис. 4. Мета-анализ 10 рандомизированных двойных слепых плацебо-контролируемых исследований аугментации антидепрессантов атипичными антипсихотиками
Арипипразол
Эффективность арипипразола изучалась в 3 рандомизированных двойных слепых плацебо-контролируемых исследованиях (Berman R. М. и соавт., 2007,2009; Marcus R.N., 2008). В группы аугментации арипипразолом и плацебо включались пациенты с текущим депрессивным эпизодом в рамках рекуррентной депрессии (РД), которые не отреагировали на адекватную антидепрессивную терапию в течение 8 недель. Во всех трех исследованиях частота ремиссии была значительно выше в группах арипипразола, чем в группах плацебо. Thase М. Е., Trivedi М. Н. и соавт. (2008) выполнили совокупный анализ 2 идентичных по дизайну 14-недельных рандомизированных двойных слепых плацебо-контролируемых исследований аугментации антидепрессантов арипипразолом при ТРД. Каждое из исследований включало 8 недель терапии СИОЗС с последующей рандомизацией в группы аугментации арипипразолом (N = 373, доза 5-20 мг/ сут) и плацебо (N=368). Комбинированная терапия продолжалась 6 недель. Результаты сводного анализа приведены на рисунке 5. Упомянутые выше исследования позволили одобрить в США медицинское применение арипипразола в качестве добавочного средства при терапевтически резистентной РД.
Кветиапин
Результаты двух недавно опубликованных исследований (El-Khalili N. и соавт., 2010; Bauer М. и соавт., 2009) продемонстрировали эффективность кветиапина в качестве средства аугментации при ТРД в рамках РД и позволили зарегистрировать это показание. В обоих исследованиях пациенты, не отрегировавшие на один адекватный курс терапии антидепрессантами, были рандомизированы в одну из групп сравнения: кветиапин 150 мг/сут, кветиапин 300 мг/сут и плацебо. В обоих исследованиях пациенты, получавшие 300 мг кветиапина, обнаружили значимую редукцию депрессивной симптоматики по сравнению с плацебо. Результаты исследования Bauer М. и соавт. (2009) приведены на рисунке 6.
Оланзапин
Наиболее изученной является комбинация оланзапина с флуоксетином. В 2007 г. Thase М. Е. и соавт. опубликовали совокупный анализ 2 идентичных по дизайну двойных слепых рандомизированных исследований, в которых сравнивалась эффективность монотерапии флуоксетином, монотерапии оланзапином, а также комбинации флуоксетина и оланзапина у больных с резистентной к терапии РД. В общей сложности в рандомизированную фазу двух исследований вошли 598 больных. Авторами показано, что из всех трех методов наиболее эффективным является сочетание оланзапина и флуоксетина. Результаты совокупного анализа двух исследований Thase М. Е. и соавт. приведены на рисунке 7.
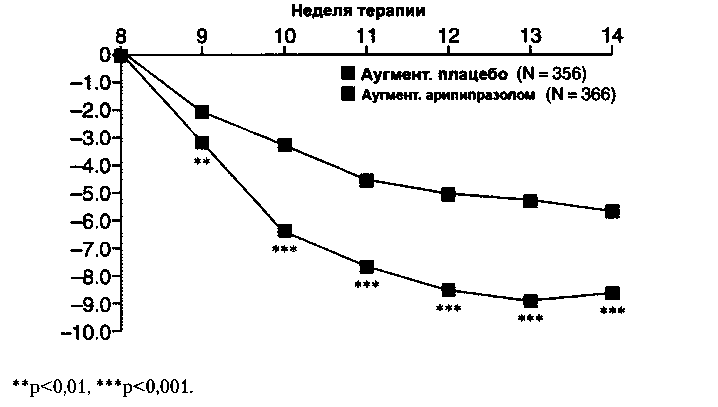
Рис. 5. Среднее изменение по шкале Монтгомери-Асберг (ось Y) в баллах в ходе двойной слепой рандомизированной фазы лечения в группах антидепрессант+плацебо и антидепрессант+арипипразол. Адаптировано из публикации Thase М. Е., Trivedi М. Н. и соавт., 2008
В совокупном анализе 5 публикаций, выполненном Tohen М. и соавт. (2010), показано, что сочетанная терапия флуоксетином и оланзапином у пациентов с ТРД превосходит по эффективности монотерапию как флуоксетином, так и оланзапином. По результатам приведенных выше исследований в 2009 году оланзапин был рекомендован в США как средство аугментации флуоксетина у пациентов с депрессией, не отреагировавших на два и более курсов терапии флуоксетином в адекватной дозе. В отношении эффективности оланзапина в сочетании с другими антидепрессантами по настоящее время не получено достоверных данных.
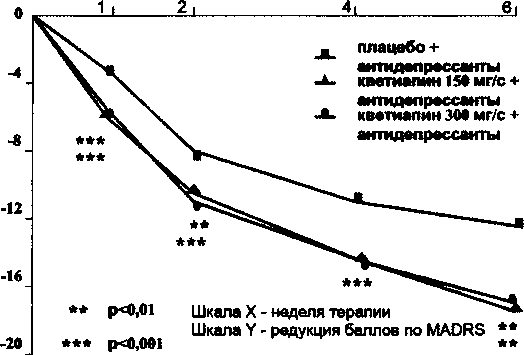
Рис. 6. Эффективность присоединения кветиапина к антидепрессантам при рекуррентной депрессии, резистентной к СИОЗС. Адаптировано из публикации Bauer М. и соавт., 2009
Рисперидон
В 3 недавних исследованиях в качестве средства аугментации при резистентной к терапии РД использовался рисперидон (Keitner G. I. и соавт., 2009; Mahmoud R. А. и соавт., 2007; Reeves Н. и соавт., 2008). В 2 исследованиях показано преимущество рисперидона над плацебо по частоте ремиссии, однако в исследовании Mahmoud R. А. и соавт. (2007) это различие не было статистически достоверным, поэтому рисперидон не был зарегистрирован как средство аугментации при лечении РД.
Другие атипичные антипсихотики
По настоящее время не опубликовано двойных слепых плацебо-контролируемых исследований клозапина, зипрасидона, палиперидона, азенапина, илоперидона в качестве средства аугментации при резистентной к терапии депрессии.
Также имеются сведения об эффективности в качестве аугментирующих средств при ТРД L-триптофана, L-дофы и других дофаминовых агонистов, резерпина, бета-адреноблокаторов, альфа-адре-ноблокаторов, иммуномодуляторов, альфа-токоферола (витамин Е) и других средств (Мосолов С. Н., 1996). Исследования этих методов аугментации были преимущественно открытыми и нерандомизированными, поэтому в настоящее время их уровень доказательности является низким.
