Электросудорожная терапия (ЭСТ)
Суть метода заключается в электрическом воздействии на головной мозг с целью провокации эпилептиформного припадка. В настоящее время в качестве стандарта безопасности используется модифицированная ЭСТ с кратковременным внутривенным наркозом, применением миорелаксантов и ИВЛ, при которой почти полностью устраняется судорожный компонент припадка. Описано множество предполагаемых механизмов терапевтической эффективности ЭСТ:
- снижение проницаемости гемато-энцефалического барьера,
- изменение концентрации нейромедиаторов,
- чувствительности и плотности рецепторов в результате влияния на различные синаптические системы,
- воздействие на диэнцэфальные структуры,
- изменение электрофизиологической активности мозга,
- нейрометаболическое действие
и многое другое (Нельсон А. И., 2005).
ЭСТ характеризуется хорошей безопасностью и переносимостью и практически не имеет абсолютных противопоказаний. Среди побочных эффектов наиболее важными являются мнестические нарушения в период лечения, которые менее выражены при унилатеральном наложении электродов.
Ряд авторов считает электросудорожную терапию „золотым стандартом» в лечении ТРД (Мосолов С. Н., 1996; Нельсон А. И., 2005; Быков Ю. В., 2009). В алгоритме лечения ТРД, предложенном Cowen P.J. (1998), автор утверждает, что ЭСТ можно применять на любой стадии лечения резистентной депрессии, в зависимости от клинической картины и от необходимости получения быстрого эффекта. Нельсон А. И. (2005) считает возможным начинать ЭСТ через 2-4 недели безуспешного лечения адекватными дозами ТЦА или гетероциклическими антидепрессантами. Психотические депрессии с острыми бредовыми переживаниями, психомоторным возбуждением и высоким риском суицида являются показанием для раннего применения ЭСТ. По данным разных источников, эффективность ЭСТ при резистентных депрессивных состояниях отмечается в 50-80% случаев (Cowen P.J., 2005). В настоящее время на отечественном рынке доступен аппарат ЭСТ „Эстер“, производимый компанией „Прима“ в г. Саратове (аппарат получил сертификацию в 2010 г.). Небольшое распространение получили зарубежные аппараты, такие как Thymatron (Somatics, LLC, США), аппараты серии Spectrum5000 (Mecta Corporation, США), Ectonustim (Ectron Limited, Великобритания) и другие.
Транскраниальная магнитная стимуляция
Транскраниальная магнитная стимуляция (ТМС) впервые применена в Англии в 1980-х годах для исследования моторных функций коры и картирования головного мозга. ТМС предполагает размещение на скальп электромагнитной катушки, в которой быстро попеременно включается и выключается ток большой мощности. Возникающее в результате магнитное поле проникает сквозь кожу, мягкие ткани и кости черепа и приводит к деполяризации нейронов моторной коры и соответствующим двигательным эффектам. ТМС с ритмически повторяемыми импульсами называется повторяющейся (repetitive) ТМС. George М. S., основываясь на собственных данных о префронтальной дисфункции при депрессиях (George М. S. и соавт., 1994), а также на взаимосвязи между изменениями в функции префронтальной коры и эффективностью ЭСТ при депрессии (George M.S., Wassermann Е. М., 1994), выдвинул предположение о том, что повторяющаяся ТМС с точкой приложения на проекцию префронтальной коры может быть эффективна при депрессии (George M.S., Wassermann Е. М., 1995). С тех пор опубликовано большое число работ, посвященных применению ТМС с различными параметрами стимуляции при депрессии, как в качестве монотерапии, так и в рамках аугментации терапии антидепрессантами (например, с СИОЗС — Сопса А. и соавт., 1996). Высокочастотная стимуляция обычно приводит к возбуждающему эффекту, а низкочастотная — к тормозящему. Также важна латерализация процедуры (право-и левосторонняя).
Среди преимуществ ТМС можно выделить неинвазивность, отсутствие необходимости в анестезии, возможность в любой момент изменить местоположение катушки и частоту воздействия, использование как стимулирующего, так и тормозящего эффектов. ТМС обычно не сопутствуют какие-либо побочные эффекты, кроме редко возникающей умеренной головной боли и дискомфорта в месте стимуляции. Среди недостатков метода выделяют недостаточную по сравнению с ЭСТ эффективность при тяжелых депрессиях, недоказанную эффективность в отдаленном периоде, невозможность напрямую стимулировать подкорковые структуры, а также неопределенность в том, как оптимально настроить параметры стимуляции. Наиболее распространенным вариантом при терапевтически резистентной депрессии является высокочастотная (частота выше 1 Гц) унилатеральная ТМС с наложением на проекцию левой дорсолатеральной префронтальной коры. Реже применяется правосторонняя низкочастотная ТМС.
В исследовании Fitzgerald Р. В. и соавт. (2006) пациенты с терапевтически резистентной депрессией подвергались последовательно левосторонней высокочастотной (10 Гц), а затем правосторонней низкочастотной (1 Гц) ТМС в проекции префронтальной коры. В исследовании показано значимое превосходство эффективности ТМС над плацебо (имитацией методики). В проведенном в нашей клинике исследовании (Ильин С. С соавт., 2008) показана несколько меньшая эффективность ТМС по сравнению с ЭСТ при затяжных, резистентных к терапии депрессиях. По другим данным (Нельсон А. И., 2005), усредненная терапевтическая эффективность ТМС при депрессиях едва достигает 60 %. По этой причине автор рекомендует использовать ТМС при относительно неглубоких и „стертых» депрессиях, а при резистентных формах отдавать предпочтение ЭСТ.
В одном метаанализе показано, что левосторонняя высокочастотная ТМС в проекции префронтальной коры статистически достоверно эффективнее своей имитации в лечении депрессии (Kozel F. A., George М. S., 2002). В другом мета-анализе (Martin J. L. и соавт., 2003) из-за низкого качества всех исследований авторы пришли к выводу, что эффективность ТМС при депрессии в настоящее время является недоказанной. Похожего мнения придерживаются Schlaepfer Т. Е. и соавт. (2003). Неоднородность терапевтических групп, их небольшой размер и различающийся дизайн каждого отдельного исследования на настоящем этапе не позволяют с уверенностью говорить об эффективности этого метода и относят его к разряду экспериментальных.
Стимуляция блуждающего нерва
Стимуляция блуждающего нерва (СБН) как метод лечения при аффективных расстройствах предложен относительно недавно, в 1994 году (George М. S.,Rush A.J., 2003). Причиной этому послужило улучшение в аффективной сфере у больных парциальной эпилепсией, получающих СБН в качестве добавочной терапии. В 2005 американское управление по контролю над качеством лекарственных препаратов и пищевых продуктов (FDA) утвердило СБН в качестве метода лечения терапевтически резистентной хронической депрессии. Суть метода заключается в следующем. Слева над ключицей пациенту имплантируется небольшой генератор, работающий от батареи, который с помощью электрода подключается к левому блуждающему нерву (левый вагус выбран из-за минимального влияния на сердечную деятельность).
Генератор посылает в нерв ритмические электрические импульсы в течение 30 секунд каждые 5 минут. Это амбулаторная методика, обычно выполняемая нейрохирургом или оториноларингологом. Анатомо-физиологическим обоснованием методики является система афферентных связей блуждающего нерва со структурами, предположительно участвующими в регуляции эмоций:
- ядром одиночного пути,
- дорсальным ядром шва,
- голубоватым пятном
и различными лимбическими структурами, в первую очередь передним островком и поясной извилиной (Nemeroff С. В. и соавт., 2006).
Кроме того, имеются сведения, что СБН вызывает усиление активности серотонинергических и норадренергических нейронов в ядрах ствола, а именно в дорсальном ядре шва и голубоватом пятне (Dorr А. Е., Debonnel G., 2006). В 12-месячное исследование George М. S., Rush A.J. и соавт. (2005) вошло две группы пациентов: группа стандартной терапии (антидепрессанты + ЭСТ по показаниям, n=124) и группа СБН (стандартная терапия + СБН, п=205). В группе СБН отмечался значительно более высокий процент респондеров (27%) по сравнению с группой стандартной терапии (13%).
В рандомизированном плацебо-контролируемом исследовании Rush A.J., Marangell L. В. и соавт. (2005) оценивалась эффективность СБН в остром периоде ТРД (10 недель, п=235, в группе плацебо применялась имитация СБН). Авторам не удалось показать какое-либо преимущество СБН над плацебо в остром периоде. В другом плацебоконтролируемом исследовании этого же коллектива авторов (Rush A.J., Sackeim Н. А. и соавт., 2005) изучалась долгосрочная эффективность СБН (12 месяцев, n=205) и было показано преимущество СБН над плацебо (28% респондеров, 16% случаев ремиссии). Недостатком дизайна этой работы являлась возможность усиления фармакотерапии на всех этапах исследования.
К преимуществам СБН можно отнести доказанную безопасность и хорошую переносимость, а также эффективность при ТРД в отдаленном периоде. Недостатками метода являются необходимость в хирургическом вмешательстве, отсутствие доказанной эффективности в остром периоде резистентной депрессии, недостаточная эффективность при относительно высокой резистентности, а также отсутствие слепых исследований. Среди побочных эффектов частыми являются охриплость голоса или желание покашлять (в этом случае пациентам рекомендуют отключать стимулятор перед публичным выступлением).
Глубокая стимуляция мозга
Глубокая стимуляция мозга (ГСМ) предполагает стереотаксическое унилатеральное или билатеральное размещение миниатюрных электродов в определенных нейроанатомических областях под контролем нейровизуализации. Электроды подключаются к проводнику, который соединен с имплантированным под кожу грудной клетки генератором импульсов. McIntyre С. С. и соавт. (2004) предполагают, что хроническая глубокая высокочастотная стимуляция приводит к снижению нейротрансмиссии в связи с блокадой деполяризации или „синаптической усталостью».
По данным Нельсона А. И. (2005), физиологическим обоснованием ГСМ является обрывание патологической циркуляции электрических импульсов в замкнутых нейронных цепях. При различных неврологических расстройствах предлагаются разные области для размещения электродов. Наибольшее распространение ГСМ получила при рефрактерной к терапии болезни Паркинсона (базальные ганглии), хронических болевых синдромах (различные корковые зоны и ядра таламуса), а также злокачественном эссенциальном треморе (ядра таламуса). При ТРД целевыми зонами для билатерального размещения электродов являются подмозолистая часть поясной извилины, а также корковая зона Бродманна 25 (ВА25). Основанием для выбора этих областей являются результаты функционального ПЭТ в исследованиях на здоровых добровольцах, у которых наблюдалось повышение метаболической активности в зоне ВА25 в периоды сниженного настроения, а также в исследованиях больных депрессией, у которых наблюдалось снижение метаболической активности в зоне ВА25 при приеме СИОЗС (Mayberg Н. S. и соавт., 1999; Kennedy S. Н., Evans К. R. и соавт., 2001; Kennedy S. Н., Konarski J. Z., 2007).
Преимуществами ГСМ являются возможность прицельно воздействовать как на корковые, так и подкорковые структуры, а также предполагаемая эффективность в остром и в отдаленных периодах депрессии. К недостаткам метода относятся инвазивность хирургической процедуры, ограниченная доступность и высокая стоимость методики, а также неопределенность в том, какие параметры стимуляции являются оптимальными. В целом исследования на небольших группах больных (в настоящее время в общей сложности опубликованы сведения о нескольких десятках больных) показывают, что ГСМ эффективна как в остром, так и отдаленном периодах депрессии. Обзор эффективности метода, его ограничения и обширный список целевых нейроанатомических зон приведены в работах Giacobbe Р. и Kennedy S. Н. (2006), а также Kopell В. Н. и соавт. (2004).
Другие нелекарственные методы
Плазмаферез (ПФ) — это метод экстракорпоральной гемокоррекции, основанный на замене плазмы крови компонентными препаратами или кровезаменителями. Предполагается, что в развитии ТРД определенную роль играет эндотоксикоз, нарушение процессов перекисного окисления липидов и изменение иммунобиологической реактивности. ПФ обладает детоксикационным, противоспалительным и иммунокоррегирующим действием, изменяет общую реактивность организма. Удаление эндотоксического субстрата приводит к деблокированию клеточных мембран и функциональному восстановлению рецепторов, тем самым восстанавливается их взаимодействие с лекарственными препаратами. Нельзя не учитывать эффекта общего „стресс-воздействия“, связанного с удалением и замещением большого объема плазмы крови. Доказанный эффект ПФ в отношении ТРД проявляется в 65% случаев (Малин Д. И., 1997; Малин Д. И. и соавт., 1998).
Атропинокоматозная терапия (АКТ), как и все „шоковые» методики, мало распространена и значительно стигматизирована во врачебной среде. Тем не менее, существует многолетний успешный опыт применения этой методики, в том числе при резистентной депрессии. Так, по данным Буйкова В. А. (2000), АКТ способствует становлению ремиссии у половины пожилых пациентов с резистентной депрессивно-деперсонализационной симптоматикой. Рассматривая возможность применения АКТ, необходимо взвешенно оценивать отношение „риск-польза». Процедура должна проводиться только при квалифицированном реанимационно-анестезиологическом обеспечении.
Магнитно-конвульсивная терапия (МКТ) является вариантом повторяющейся ТМС с усилением мощности, необходимым для провокации эпилептиформного припадка. Сведения об антидепрессивной активности МКТ пока единичны (Lisanby S. Н., 2001). Предполагается, что МКТ приводит к менее выраженным по сравнению с ЭСТ когнитивным и мнестическим нарушениям.
Внутривенное лазерное облучение крови (БЛОК) подразумевает физическое воздействие на кровь при помощи гелий-неонового лазера. Установлено, что БЛОК повышает общую реактивность организма, оказывает адаптогенное, антигипоксическое, мембраностабилизирующее, мембранопротекторное и стимулирующее действие (Вернекина Н. С. и соавт., 1994). В небольшом исследовании Сайкина М. А. и соавт. (1998) у 13 из 21 (61,9 %) больных со стойкой депрессивной симптоматикой показана 50 %-редукция по шкале Гамильтона через 3 недели лазеротерапии. Малая эффективность БЛОК при тревожно-депрессивных состояниях, обнаруженная в этом исследовании, согласуется с данными Шпиленя Н. С. и соавт. (1994). Несмотря на хорошую переносимость, безопасность и обнадеживающие данные об эффективности, БЛОК пока не получило должного распространения.
Нормобарическая гипоксия. Данная методика подразумевает адаптацию ЦНС к периодической нормобарической гипоксии с использованием специального оборудования и газовых смесей. В работе Каримулаева И. А. (2002) на материале из 28 больных показана эффективность данного метода при фармакорезистентной депрессии. Через 15-16 сеансов число респондеров, т.е. лиц, у которых редукция депрессивной симптоматики по шкале Гамильтона превышала 50 % от исходного уровня, составило 57 % (методика применялась в дополнение к терапии кломипрамином или мапротилином).
В настоящий обзор не вошли некоторые хорошо зарекомендовавшие себя методики, а именно депривация сна, терапия ярким белым светом, рефлексотерапия, диетотерапия и другие.
С учетом изложенных выше новых данных и уровней доказательности того или иного метода лечения ТРД мы видоизменили предложенный ранее (Мосолов С. Н., 1996) эмпирический алгоритм терапии терапевтически резистентной рекуррентной депрессии (см. рис. 8).
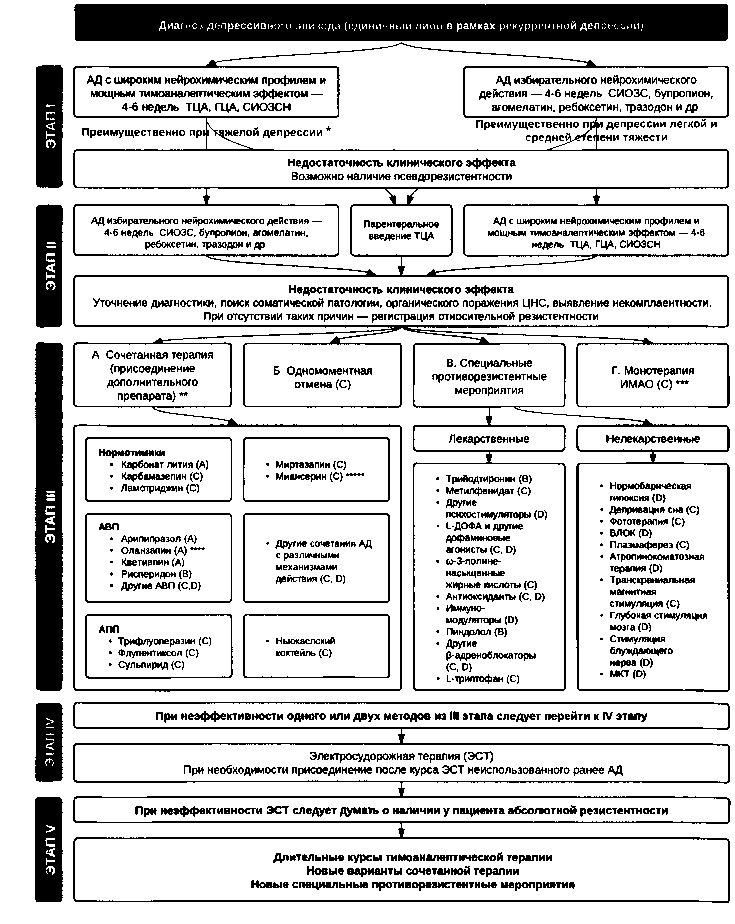
Рис. 8. Алгоритм действий при терапевтически резистентной рекуррентной депрессии. Примечания: * При наличии в структуре тяжелого депрессивного эпизода бредовых расстройств целесообразно на первом этапе включить в схему терапии антипсихотик (предпочтительно, АВП). В случае моторных нарушений (ступора), тяжелых галлюцинаторно-бредовых расстройств, высокого суицидального риска рекомендуется раннее применение ЭСТ (на первом этапе). ** Последовательность перечисления мероприятий внутри предложенных вариантов значения не имеет. ** * Особенно эффективно при атипичной депрессии. **** Доказана эффективность только в сочетании с флуоксетином ***** Обнаружена эффективность в сочетании с СИОЗС.
Список сокращений
- АД = антидепрессант
- АПВ — антипсихотики второго поколения
- АПП = антипсихотики первого поколения
- БЛОК — внутривенное лазерное облучение крови
- ГЦА = гетероциклические антидепрессанты
- ИМАО = ингибиторы моноаминооксидазы
- МКТ = магнитно-конвульсивная терапия
- СИОЗС = селективные ингибиторы обратного захвата серотонина
- СИОЗСН = селективные ингибиторы обратного захвата серотонина и норадреналина
- ТЦА = трициклические антидепрессанты
- ЭСТ — электросудорожная терапия
Категории доказательности, использованные в алгоритме:
- Доказательства получены на основе хорошо спланированных рандомизированных контролируемых исследований с воспроизводимыми результатами. Получено подтверждение с помощью мета-анализа.
- Доказательства получены на основе ограниченного числа рандомизированных контролируемых исследований с неоднородными результатами и/или несовершенством методологии и/или недостаточным количеством пациентов.
- Доказательства получены, преимущественно, на основе открытых, нерандомизированных исследований. Опубликованы сведения об успешном клиническом применении.
- Метод/лекарственный препарат относится к разряду экспериментальных. Достоверных доказательств эффективности в настоящее время не получено.
Первый этап лечения тяжелого депрессивного эпизода (единичного либо в рамках рекуррентной депрессии) предполагает применение АД с широким нейрохимическим профилем и мощным тимоаналептическим эффектом (ТЦА, ГЦА, СИОЗСН) в течение 4-6 недель. При наличии в структуре тяжелого депрессивного эпизода бредовых расстройств целесообразно на первом этапе включить в схему терапии антипсихотик (предпочтительно, АВП). В случае моторных нарушений (ступора), галлюцинаторно-бредовых расстройств, высокого суицидального риска рекомендуется раннее применение ЭСТ (на первом этапе).
В случае депрессии средней и легкой степени тяжести целесообразно начать терапию с АД избирательного нейрохимического действия:
- серотонинергического (СИОЗС, тразодон и другие),
- норадренергического (дезипрамин, мапротилин, ребоксетин и другие),
- дофаминергического (бупропион),
- АД с другими механизмами действия (агомелатин) также в течение 4-6 недель.
При отсутствии или недостаточности клинического эффекта возможно наличие псевдорезистентности, связанной с неадекватным применением антидепрессанта, например, с несоблюдением режима приема, недостаточной дозировкой, индивидуальными фармакокинетическими особенностями (например, нарушением всасывания в ЖКТ или метаболизма, лекарственным взаимодействием) и др.
На втором этапе выполняется замена текущей терапии:
- в случае если на первом этапе использовался АД с широким нейрохимическим профилем, назначается АД избирательного действия (также на 4-6 недель);
- в случае, если на первом этапе использовался АД избирательного действия, назначается АД с широким нейрохимическим профилем. В случае выявления псевдорезистентности возможен переход к парентеральному введению ТЦА в течение 4-6 недель.
При отсутствии или недостаточности клинического эффекта выполняется повторное тщательное обследование с целью выявления некомплаентности, сопутствующей органической патологии ЦНС, соматического заболевания и других причин, снижающих эффективность тимоаналептической терапии.
В случае невыявления таких причин регистрируется относительная резистентность и выполняется переход к собственно противорезистентным мероприятиями — третьему этапу, который включает 4 примерно равноценных варианта действий. Выбор конкретного метода определяется врачом в зависимости от индивидуальных особенностей состояния пациента.
- А. Аугментация используемого в настоящее время АД дополнительным средством. Наиболее изученными средствами аугментации с доказанной эффективностью являются: карбонат лития, арипипразол, оланзапин (в сочетании с флуоксетином), кветиапин. Остальные распространенные средства аугментации с указанием категории доказательности приведены в алгоритме.
- Б. Одномоментная отмена с диуретиками или терапией „прикрытия».
- В. Специальные противорезистентные мероприятия — лекарственные и нелекарственные. Среди первых наиболее изученными являются добавление в схему лечения трийодтриронина и бетаадреноблокатора пиндолола. Остальные противорезистентные средства приведены в алгоритме. Среди нелекарственных методик наиболее изученными и хорошо себя зарекомендовавшими являются ТМС, депривация сна, фототерапия, плазмаферез. Остальные методы в настоящее время не получили широкого распространения в виду относительной сложности выполнения и/или их экспериментального характера.
- Г. Монотерапия ИМАО (данный метод особенно эффективен при атипичных депрессиях).
Порядок перечисления мероприятий внутри предложенных вариантов третьего этапа значения не имеет, хотя уровень имеющихся доказательств в отношении каждого метода может отличаться.
В случае неэффективности всех описанных выше мероприятий после 1-2-недельной отмены терапии переходят к четвертому этапу -курсу из 8-12 процедур билатеральной или унилатеральной ЭСТ.
В случае неэффективности всех перечисленных этапов следует думать об абсолютной резистентности и переходить к пятому этапу, включающему длительные курсы антидепрессивной терапии, новые варианты сочетанной терапии и противорезистентные мероприятия.
В заключение подчеркнем, что в настоящее время не разработано единого клинически и биологически подтвержденного понятия терапевтически резистентной депрессии. ТРД не является отдельной нозологической единицей и обычно относится к „затяжным» или „тяжелым» депрессиям. Во многих случаях ятрогенные факторы и некомплаентность больных приводят к формированию псевдорезистентности. Почти в половине случаев ТРД сопутствует нераспознанная соматическая патология. Кроме того, важную роль в развитии ТРД играют психологические и личностные особенности пациентов. Все упомянутые в настоящем обзоре алгоритмы и биологические методы не могут быть полностью эффективны без тщательного анализа клинической ситуации, коррекции соматических нарушений, а также психотерапевтической и психосоциальной работы с больным.