Содержание воды в организме и механизмы регуляции водного баланса.
Вода — один из важнейших компонентов живого организма. У новорожденных детей она составляет 75 — 80% массы тела, у взрослых мужчин массой около 70 кг 53 —55 %, а у женщин 43 —46 %. Из этого количества на внутриклеточную воду приходится 25 — 30 % у мужчин и 18 — 20% у женщин, а на внеклеточную у тех и других — около 25 %. В свою очередь внеклеточная вода складывается из интерстициальной (около 15 %), плазменной (4 — 5%) и трансцеллюлярной (1 — 2%). К трансцеллюлярной жидкости относится камерная влага глаз, спинномозговая, суставная, или синовиальная, жидкость, содержимое почечных канальцев, пищеварительные соки. По мере старения организма общее количество воды уменьшается до 50 % от массы тела у мужчин и 42—44 % у женщин. При этом количество внутриклеточной воды уменьшается, а внеклеточной — увеличивается.
В течение суток у новорожденного обменивается около 50 % объема внеклеточной воды, у взрослого около 15%. За сутки в организм взрослого человека должно поступать около 2,5— 2,7 л воды (около 1.3—1,5 л с питьем, около 1 л с пищей, 0,2—0,4 л воды образуется эндогенно в результате метаболизма). Для сохранения водного баланса и гомеостаза суточное выделение воды из организма должно соответствовать поступлению, т.е. составлять 2,5—2,7 л. При этом около 1,4—1,6 л воды выделяется с мочой, около 0,5—0,7 л выводится через легкие; 0,5—0,7 л — через кож:у и около 0,05— 0,1 л — с калом. Поступление воды регулирует ЦНС (центр жажды).
У здорового человека в оптимальных условиях (температура, влажность и т.д.) через легкие, кожу и кишечник выделяется постоянное количество воды, а сохранение водного баланса обеспечивается в основном выделительной функцией почек, в регуляции которой важнейшую роль играют: антидиуретичеекий гормон гипофиза (АДГ, вазопрессин), ренин — ангиотензин — альдостероновая система, предсердный натрийуретический фактор (ПНФ), простагландины, катехоламины, глюкокортикоиды и др.
Роль антидиуретического гормона.
Данный гормон секретируется в супраоптических и паравентрикулярных ядрах гипоталамуса, накапливается в задней доле гипофиза и выделяется из нее при определенных условиях:
- при увеличении осмоляльности плазмы крови;
- уменьшении наполнения артериальных сосудов шеи и грудной клетки (уменьшение объема циркулирующей крови, длительное вертикальное положение человека);
- некоторых стрессовых ситуациях (боль, волнение); тошноте, рвоте;
- под влиянием ангиотензина-II, p-адреномиметиков. ацетилхолина, никотина, фенобарбитала, эфира.
Раздражая V2-рецепторы эпителия дистальных канальцев и собирательных трубочек почек, АДГ увеличивает реабсорбцию воды, задерживая ее в организме. Кроме того, АДГ (вазопрессин) участвует в поддержании сосудистого тонуса и регуляции артериального давления. При повышенной его секреции возникает спазм сосудов в результате раздражения V1 рецепторов гладких мышц и увеличения в них содержания ионов Са2+.
Выделение АДГ может тормозиться:
- при уменьшении осмоляльности плазмы крови;
- увеличении наполнения артериальных сосудов шеи и грудной клетки (гиперволемия, длительное горизонтальное положение человека, состояние невесомости и др.); охлаждении;
- под влиянием α-адреномиметиков, этанола, морфина, резерпина, глюкокортикоидов (при одновременном повышении чувствительности рецепторов почечных канальцев к АДГ).
При уменьшении выделения АДГ диурез увеличивается и больше воды выводится из организма.
При врожденном или приобретенном дефиците АДГ развивается синдром «несахарного мочеизнурения» (диабета), характеризующийся полиурией до 10—20 л в сутки с низкой плотностью мочи и компенсаторной полидипсией (жаждой). Возможно также развитие нефрогенного несахарного мочеизнурения, обусловленного врожденной или приобретенной нечувствительностью рецепторов почек к АДГ (например, при гипокалиемии или гиперкальциемии). Синдром неадекватной секреции АДГ может наблюдаться при опухолях задней доли гипофиза, нарушениях нейроэндокринной регуляции, под влиянием химических веществ (литий), лекарственных препаратов (диметилхлортетрациклин и др.), а также при введении регуляторных механизмов «в заблуждение». Примеры ошибочного регулирования водно-электролитного баланса будут рассмотрены далее.
Роль ренин-ангиотензин-альдостероновой системы.
Из субстрата, вырабатываемого печенью, в юкстагломерулярном аппарате почек образуется и накапливается в виде гранул ренин (гликопротеин молекулярной массой 40000), который как гормон выделяется в кровь при определенных состояниях:
- уменьшении почечного кровотока, обусловленного как заболеванием самих почек, так и уменьшением ОЦК, снижением АД;
- увеличении в моче содержания натрия и хлора;
- влиянии адреномиметиков, простациклина и др.
В плазме крови под влиянием ренина из α2-глобулина образуется декапептид ангиотензин-1 (АТ-1), который при участии конвертирующего (превращающего) фермента (АПФ), преимущественно в легких, превращается в октапептид ангиотензин-II (AT-II) и далее в гептапептид ангиотензин-III (AT-III).
АТ-II стимулирует центр жажды, обладает прессорными свойствами (вызывает спазм сосудов) и стимулирует выделение АДГ, что способствует задержке воды в организме. Кроме того, AT-II и AT-III являются мощными стимуляторами клубочковой зоны коры надпочечников и, раздражая специальные рецепторы, усиливают выделение минералокортикоида альдостерона. Выделение альдостерона может усиливаться также под влиянием гипонатриемии. гиперкалиемии, ПГЕ, АКТГ.
Альдостерон, раздражая специальные рецепторы в дистальных канальцах и собирательных трубочках почек, дистальных отделах толстого кишечника, а также слюнных и потовых железах вызывает усиление синтеза различных специализированных внутриклеточных белков, которые увеличивают реабсорбцию ионов Na+ и секрецию ионов К+ и Н+. Задержка ионов Na+ в плазме крови сопровождается увеличением ее осмоляльности, что по описанному выше механизму приводит к выделению АДГ и усилению реабсорбции воды, уменьшению диуреза и задержке воды в организме.
Необходимо отметить, что. помимо стимуляторов ренин-ангиотензин-альдостероновой системы, существуют ее естественные и искусственные ингибиторы. Так. например, выделение ренина из ЮГА почек тормозят: АДГ, альдостерон (по принципу обратной связи), адреноблокаторы, индометацин, а также такие факторы, как увеличение объема циркулирующей крови (OЦK), гипернатриемия и др. Блокаторы конвертирующего фермента (например, эналоприл, лизиноприл и др.) препятствуют превращению АТ-I в AT-II и AT-III. Предсердный натрийуретический фактор (ПНФ), блокируя рецепторы AT-II и AT-III в клубочковой зоне надпочечников, тормозит выделение альдостерона. Его выделение уменьшается также при увеличении ОЦК, гипернатриемии, гипокалиемии, под влиянием дофамина. Наконец, блокировать рецепторы альдостерона в почках, кишечнике, слюнных и потовых железах могут альдактон, спиронолактон и др.
Эта сложная регуляторная система в здоровом организме включается быстро и достаточно надежно поддерживает водно-электролитный баланс, от которого зависят ОЦК, величина АД, деятельность сердца, почек и других систем организма.
Однако в ряде случаев при поражении надпочечников продукция альдостерона может быть пониженной (болезнь Аддисона) или повышенной (гиперкортииизм, первичный альдостеронизм). Избыточное выделение альдостерона может быть результатом «ошибочного регулирования» (вторичный альдостеронизм). В этих случаях развиваются выраженные нарушения водно-электролитного обмена, примеры которого будут описаны далее.
Рассмотренные выше механизмы регулируют прежде всего содержание общей воды на уровне целого организма и величину ОЦК. Обмен воды между сосудистым руслом и тканями осуществляется по известному механизму, описанному Э.Старлингом (1896), суть которого сводится к следующему. Через стенки капилляров достаточно легко перемещаются вода, электролиты. некоторые органические соединения, но труднее транспортируются белки. Концентрация белка в плазме крови составляет 60 — 80 г/л, а в тканевой жидкости колеблется от 10 до 30 г/л. При этом величина онкотического давления крови равна 25 — 28 мм рт.ст.. а в интерстициальном пространстве — около 5 мм рт. ст. Разность этих величин (19 — 22 ммрт. ст.) называется эффективной онкотической всасывающей силой (ЭОВС), под действием которой вода всасывается в капилляры из интерстициального пространства. Но кровь движется в сосудах с определенной скоростью и под определенным давлением. Гидростатическое давление крови в капиллярах неодинаковое и колеблется от 30— 32 мм рт. ст. в артериальном конце капилляра до 8 — 10 мм рт. ст. в венозном конце. Величина давления тканевой жидкости — отрицательная (на 6 — 7 мм рт. ст ниже величины атмосферного давления) и обладает присасывающим эффектом. Разность между гидростатическим давлением крови и давлением интерстициальной жидкости называется эффективным гидростатическим давлением (ЭГД), которое колеблется от 36—38 мм рт. ст. в артериальном конце капилляра до 14—16 мм рт. ст. в венозном конце.
В тех капиллярах, где эффективное гидростатическое давление выше эффективных онкотических сил всасывания, происходит фильтрация жидкости из сосудов в интерстициальное пространство, а в тех капиллярах, где первая величина меньше второй — резорбция (всасывание) жидкости из ткани в сосудистое русло. Следует отметить, что один и тот же капилляр в зависимости от интенсивности кровообращения (покой или нагрузка) может или фильтровать жидкость, или всасывать ее. У здорового человека за сутки из крови в ткань фильтруется до 20 л жидкости, 17 л всасывается обратно в капилляры и около 3 л оттекает из ткани по лимфатическим капиллярам и через лимфатическую систему возвращается в сосудистое русло. Нарушение обмена воды между кровью и интерстициальным пространством может наблюдаться при определенных условиях: при изменениях гидростатического давления в капиллярах, онкотического давления — в крови и интерстиции, повышении проницаемости сосудистой стенки для белков, при нарушениях лимфооттока.
Обмен жидкости между внутриклеточным и внеклеточным пространством происходит по «закону изоосмолярности», согласно которому вода перемещается через биологические мембраны в сторону большего осмотического давления до тех пор, пока осмолярность по обе стороны мембраны не уравняется. В норме осмоляльность внутри и вне клеток равна 285 мосмоль/кг Н2O и зависит в основном от содержания ионов Na+, глюкозы, мочевины и других осмотически активных веществ, содержание которых может изменяться при патологии почек, надпочечников, при сахарном диабете, повреждении клеток и т. д. Это может повлечь за собой или обезвоживание клеток (при увеличении осмоляльности внеклеточной жидкости), или их гипергидратапию (при уменьшении осмоляльности внеклеточной жидкости).
Следует отметить также, что и внутри, и вне клеток часть воды находится в связанном, а часть — в свободном (мобильном) состоянии. Количественное соотношение этих фракций воды в различных органах неодинаковое и может изменяться при патологии.
Виды нарушений водно-электролитного обмена.
Все нарушения водного обмена в организме (дисгидрии) принято подразделять на два основных вида: гипогидратацию и гипергидратацию, которые в свою очередь в зависимости от величины осмоляльности внеклеточной жидкости подразделяют: на изоосмоляльную (изотоническую), гипоосмоляльную (гипотоническую), гиперосмоляльную (гипертоническую).
Выделяют также ассоциированные формы нарушений: внеклеточную гипогидратацию с внутриклеточной гипергидратацией, и наоборот, а также гипо- и гиперосмоляльные синдромы.
Причины, патогенез, виды и последствия обезвоживания для организма. Обезвоживание (гипогидратация, дегидратация, эксикоз) развивается в тех случаях, когда потери воды превышают поступление ее в организм и развивается отрицательный водный баланс. Недостаточное поступление воды в организм наблюдается при водном голодании, повреждении центра жажды, при неврологических и психических заболеваниях, коматозных состояниях, при затруднении глотания, непроходимости пищевода и др. При полном прекращении поступления воды в организм продолжительность жизни взрослого человека составляет 6 — 8 сут, а ребенка массой около 7 кг — в два раза меньше. Маленькие дети больше воды теряют через кожу и легкие (перспирация), а также с мочой, так как окончательное формирование всех функций почек завершается только в возрасте 11 лет. У детей интенсивнее происходит обмен внеклеточной воды и значительно выше чувствительность к ее дефициту.
Повышенная потеря воды из организма может происходить в результате следующих причин:
- массивная кровопотеря;
- полиурия;
- неукротимая рвота;
- профузный понос;
- желудочно-кишечные свищи;
- гипервентиляция легких;
- усиленное потоотделение (перспирация воды до 10—14 л в сутки);
- лихорадка (повышение температуры тела на 1°С сопровождается потерей 0,5 л воды);
- обширные ожоги с ликвореей; диабетические комы (кетоацидотическая и особенно гиперосмолярная);
- первичный дефицит электролитов в организме.
При эквивалентной потере воды и электролитов, т.е. в тех случаях, когда теряется жидкость, по электролитному составу близкая к плазме крови и интерстициальной жидкости, развивается изоосмоляльная гипогидратация. Ее можно наблюдать у больных в I стадии после массивной кровопотери, у больных с кишечным токсикозом (дизентерия, энтерит, холера, язвенный колит), при стенозе привратника, при высокой непроходимости тонкого кишечника, т.е. при состояниях, сопровождающихся обильной рвотой или диареей, а также при массивных ожогах, кишечных свищах, длительном применении некоторых диуретиков и в других случаях.
При этом в виде обезвоживания осмоляльность внутри и вне клеток не изменяется, уменьшается в основном объем внеклеточной воды, и ведущие симптомы обусловлены, главным образом, нарушением кровообращения (уменьшением минутного объема сердца — МОС, АД, центрального венозного давления — ЦВД и др.).
Если потеря электролитов преобладает над потерей воды, то развивается гипоосмоляльная гипогидратация. Так как при этом осмотическое давление внутри клеток оказывается выше, чем во внеклеточном пространстве, то вода по закону изоосмоляльности перемешается в клетки, вызывая их отек и набухание.
Причинами гипоосмолярного обезвоживания могут стать:
- обильное и длительное потоотделение;
- дефицит минералокортикоидов при недостаточности надпочечников (болезнь Аддисона):
- рвота, понос;
- коррекция изоосмолярного обезвоживания водой без электролитов и др.
При неправильном проведении гемодиализа или перитонеального диализа быстрое снижение осмолярности плазмы может вызвать отек нервных клеток, судороги, кому.
Последствия обезвоживания такого характера обусловлены нарушениями кровообращения, значительным уменьшением ОЦК, увеличением вязкости крови, нарушениями сердечной деятельности (уменьшение ударного объема сердца — УОС, МОС), нарушением кислотно-основного состояния (при неукротимой рвоте наблюдается алкалоз, при профузном поносе — ацидоз), выраженной гипоксией.
Важно отметить, что при гипоосмолярной гипогидратации у больных может отсутствовать жажда (так как осмолярность плазмы низкая, а в клетках воды много).
Если потеря воды преобладает над потерей солей, то развивается гиперосмолярная гипогидратация. Она наблюдается при недостаточном поступлении воды в организм, лихорадке с обильным потоотделением, искусственной вентиляции легких без увлажнения дыхательной смеси, при несахарном мочеизнурении, инфузиях гипертонических растворов и средств парентерального питания, при питье морской воды на фоне обезвоживания при сахарном диабете и др.
На фоне общего обезвоживания воду в основном теряют клетки, так как она будет перемещаться во внеклеточное пространство, т.е. в сторону большего осмотического давления. Для таких больных характерна мучительная жажда, неврологические симптомы: возбуждение, беспокойство, спутанность сознания, повышение температуры тела и др.
Компенсаторные изменения при обезвоживании сводятся к рефлекторному возбуждению центра жажды (исключая гипоосмолярную форму) под влиянием гиперосмолярности плазмы, уменьшения объема внутриклеточной воды и AT-II. Полидипсия приводит к увеличению поступления воды (если это возможно).
Жажда может появиться даже при небольшом дефиците воды, сопровождающемся гипернатриемией. Дефицит 3 — 4 л воды вызывает мучительную жажду. Активизируется ренин-ангио-тензин-альдостероновая система (по описанному выше механизму), увеличивается секреция АДГ гипофизом, диурез уменьшается и вода задерживается в организме. Компенсаторные изменения оказываются достаточными только при легкой форме обезвоживания, когда дефицит воды составляет меньше 5 % нормы. При этом у больных могут отсутствовать типичные симптомы обезвоживания, не считая тахикардии. При дефиците воды 5— 10 % развивается обезвоживание средней тяжести, более 10% — тяжелая дегидратация. Дефицит воды более 12% приводит к развитию гиповолемического шока и почечной недостаточности (табл. 9.2).
Последствия гипогидратации зависят в основном от ее тяжести, но для всех форм обезвоживания характерны следующие симптомы: сухость кожи (особенно в подмышечной и паховой области), сухость слизистых оболочек, гипосаливация (при длительном процессе способствует развитию воспалений в ротовой полости); гладкий красный с глубокими морщинами язык; запавшие и мягкие при надавливании глазные яблоки; сниженный тургор тканей (кожи, мышц).
Выявляются признаки нарушения сердечной деятельности (тахикардия, уменьшение ударного и минутного объема, возможна остановка сердца); снижается артериальное и центральное венозное давление, нарушается периферическое кровообращение (в тяжелых случаях может развиться коллапс).
Из-за ослабления почечного кровотока, уменьшения фильтрации в клубочках и увеличения реабсорбции воды в канальцах почек снижается диурез. На фоне олиго- и анурии могут появиться признаки почечной недостаточности (азотемия, ацидоз и др.). Угнетается перистальтика желудка и кишечника, нарушаются процессы переваривания и всасывания, могут быть запоры, парезы кишечника и другие расстройства. Из неврологических симптомов следует обратить внимание на слабость, вялость, апатию, сонливость или возбуждение, повышение температуры тела, в тяжелых случаях помрачение сознания, галлюцинации, бред.
Принципы терапии обезвоживания сводятся к устранению причины, вызвавшей его, к введению изотонических или гипертонических растворов в зависимости от вида обезвоживания. Коррекцию проводят обязательно пол контролем осмометрии, рН-метрии г других показателей гомеостаза. Применяют средства, улучшающие микроциркуляцию и реологические свойства крови, проводят симптоматические мероприятия.
Гипергидратация. Задержка воды ворганизме (гипергидратация, гипергидрия) наблюдается или при чрезмерном введении воды (водная интоксикация) или при недостаточном ее выведении из организма. В обоих случаях развивается положительный водный баланс Аналогично обезвоживанию в зависимости от величины осмоляльности внеклеточной жидкости гипергидратация может быть изоосмоляльной, гиперосмоляльной и гипоосмоляльной.
Изоосмолярная гипергидратация развивается при вливании больших количеств изотонических растворов, при сердечно-сосудистой недостаточности, токсикозах беременности, болезни Иценко — Кушинга (избыточной продукции АКТГ гипофизом), вторичном альдостеронизме, при гипопротеинемиях (нефротический синдром, голодание, печеночная недостаточность), при нарушениях лимфооттока.
Последствия такой гипергидратации сводятся к увеличению ОЦК (олигоцитемическая гиперволемия), повышению АД, перегрузке сердца с риском развития его недостаточности, а также к выраженному отечному синдрому с угрозой развития в тяжелых случаях отеков легких, мозга.
Гиперосмоляльная гипергидратация развивается в тех случаях, когда задержка солей преобладает над задержкой воды и осмоляльность внеклеточной жидкости оказывается больше, чем внутри клеток.
Это может наблюдаться при введении больших количеств гипертонических растворов, при вынужденном неограниченном питье морской воды, осмоляльность которой значительно превышает осмоляльность плазмы крови; при первичном и вторичном альдостеронизме; при патологиях почек, характеризующихся преимущественным нарушением выведения солей (тубулопатии, ферментопатии), а также мочевины (почечная недостаточность).
При этом на фоне увеличения объема и осмоляльности внеклеточной жидкости происходит обезвоживание клеток. Возникает внутриклеточная дегидратация на фоне внеклеточной гипергидратации (ассоциированное нарушение). Несмотря на избыток воды в организме больных беспокоит жажда, а дополнительное поступление воды только усугубляет процесс.
У больных резко возрастают ОЦК, артериальное и центральное венозное давление, развивается перегрузка сердца (возможна его остановка), выражены неврологические симптомы, признаки повышения внутричерепного давления, могут развиться отеки мозга, легких.
Гипоосмоляльная гипергидратация развивается в том случае, когда задержка воды в организме сопровождается снижением осмолярности внеклеточной жидкости. Такие нарушения могут возникать при чрезмерном введении бессолевых растворов, превышающем выделительную способность почек; при повышенной секреции АДГ, циррозе печени, почечной недостаточности, недостаточности кровообращения с отечным синдромом и др.
У больных увеличивается объем внеклеточной воды, гиперволемия выражена слабее, чем при описанных формах гипергидрии, так как значительная часть воды перемещается в сторону большего осмотического давления, т.е. внутрь клеток, вызывая их осмотическое повреждение и развитие синдрома водной интоксикации (водного отравления). Происходит гемолиз эритроцитов, полиурия сменяется анурией с признаками почечной недостаточности. Характерны рвота, понос. Рано появляются неврологические симптомы: вялость, апатия, судороги, помрачение сознания.
Следует отметить, что уменьшение осмоляльности плазмы крови менее 280 мосмоль/кг Н2О, независимо от общего количества воды в организме (гипо- или гипергидратация), называется гипоосмоляльным синдромом. Он всегда сопровождается гипергидратацией клеток и признаками водной интоксикации (даже на фоне обезвоживания). Снижение осмоляльности плазмы ниже 250 — 230 мосмоль/кг Н2O приводит к смерти. Наиболее частыми причинами развития этого синдрома являются потеря натрия с мочой при дефиците альдостерона или нечувствительности к нему канальцев почек; интенсивная потеря натрия с потом, рвотными массами, поносом, а также чрезмерное разведение его концентрации на фоне гипергидратацпи.
При увеличении осмоляльности плазмы крови более 300 мосмоль/кг Н2O (на фоне как гипо-, так и гипергидратации) развивается гиперосмоляльный синдром, сопровождающийся клеточной дегидратацией. Он наблюдается у больных на фоне гипернатриемии (более 150 — 200 ммоль/л) алиментарного происхождения, при гломеруло-нефрите, белковом голодании, первичном альдостеронизме, лихорадке, длительном приеме глюкокортикоидов и др. Гиперосмолярность плазмы и внеклеточной жидкости возникает у больных сахарным диабетом за счет увеличения в крови глюкозы и других осмотически активных веществ. Оба синдрома схожи по клиническим проявлениям, так как в обоих случаях ведущими являются неврологические нарушения (рвота, судороги, кома), но тактика врача должна быть разной. Коррекцию проводят строго под контролем осмометрии.
Компенсаторные изменения в организме при гипергидратации зависят от причины, вызвавшей ее. При избыточном поступлении воды в организм увеличивается ОЦК и тормозится выделение АДГ, повышается диурез. Положительный водный баланс развивается только в том случае, если поступление воды превышает выделительную функцию почек, а также на фоне гипернатриемии. Задержка воды, обусловленная олигурией (анурией), при почечной недостаточности по понятным причинам не имеет эффективных механизмов компенсации, быстро приводит к развитию гипергидратации, отечных синдромов с угрозой для жизни больного, и такое состояние нуждается в срочной коррекции (например, путем гемодиализа).
При застойной форме сердечной недостаточности, некоторых заболеваниях печени, почек и других состояниях, сопровождающихся уменьшением наполнения артериальных сосудов, ослаблением почечного кровотока, стимуляцией адренергической системы. Ренин-ангиотензин-альдостероновая система, как правило, активизируется, развивается вторичный альдостеронизм, повышается продукция АДГ и. несмотря на уже имеющуюся гипергидратацию, происходит задержка воды в организме. Вместо компенсации регуляторные системы только усиливают положительный водный баланс и играют важную роль в патогенезе возникающих при этом отеков.
Виды, патогенез, принципы коррекции различных отеков.
Отек (oedema) — это избыточное накопление жидкости в тканях.
Накопление жидкости в полостях называется водянкой (hydrops). Жидкость может накапливаться в брюшной полости (ascites), плевральной полости (hydrothorax), желудочках мозга (hydrocephalus), в околосердечной сумке (hydropericardium). Скопившаяся в тканях или полостях воспалительная жидкость называется экссудатом, а невоспалительная — транссудатом. Он содержит мало белка и клеток.
Механические отеки.
Если ведущую роль в патогенезе отеков играет увеличение эффективного гидростатического давления в капиллярах, например, при местной венозной гиперемии, то такие отеки называются механическими. При этом жидкость задерживается в тканях в результате уменьшения или полного прекращения ее резорбции в капилляры, в которых эффективное гидростатическое давление становится равным или даже превышающим эффективную осмотическую силу всасывания, а также из-за недостаточности лимфооттока, обусловленного отечной жидкостью. Коррекция этих отеков сводится к устранению причины венозного застоя.
Мембраногенные отеки.
Отеки, в патогенезе которых главную роль играет повышение проницаемости сосудистой стенки для белка, например, при воспалении, аллергии, укусе насекомых, называются мембраногенными. В этих случаях под влиянием токсинов насекомых или медиаторов воспаления, аллергии (гистамина, серотонина, брадикинина, анафилатоксинов, протеаз и др.) повышается проницаемость капилляров, белок, вышедший в интерстициальное пространство, повышает онкотическое давление вне сосудов, эффективная онкотическая сила всасывания в сосудах уменьшается и жидкость задерживается в тканях.
Данные отеки являются местными и существенно не влияют на водный баланс в целом организме. Для лечения таких отеков используют противовоспалительные, противоаллергические препараты.
Нейрогенные отеки.
Повышение проницаемости сосудов играет ведущую роль и в механизме нейрогенных отеков, которые наблюдаются при сирингомиелии (образовании полостей в сером веществе спинного мозга), спинной сухотке (поражении задних столбов и рогов спинного мозга), при контузиях, истерии. Развитием отека лица часто сопровождается невралгия тройничного нерва.
Отек Квинке.
По механизму развития отек Квинке также является нейрогенным и мембраногенным. Он чаще локализуется на лице, но может возникать и в других местах на коже и во внутренних органах (в пищеводе, желудке, кишечнике, дыхательных путях, матке). Появление его в глотке, в дыхательных путях может вызвать острую асфиксию и привести к смерти. Отек Квинке может быть аллергическим и псевдоаллергическим (наследственный ангионевротический отек Квинке, обусловленный дефицитом ингибиторов протеаз, в частности ингибитора С1-компонента комплемента). Развитие такого отека может быть спровоцировано действиями стоматолога: надавливание на губу, вмешательства в ротовой полости. Такой отек развивается в течение нескольких минут, холодный и плотный наощупь, чаще бледный, держится до нескольких часов и исчезает сам.
Лимфатические отеки.
Данные отеки могут быть местными и распространенными. Их развитие связано с механической лимфатической недостаточностью, обусловленной сдавливанием лимфатических сосудов (рубцами, опухолью), их спазмом (при повышении давления в правом предсердии), а также их закупоркой (паразитами). В последнем случае развивается задержка тканевой жидкости (лимфостаз) и тяжелый, не поддающийся лечению, синдром слоновости (elephantiasis). Динамическая лимфатическая недостаточность развивается вследствие перегрузки лимфооттока и участвует в патогенезе отеков различного происхождения, например: играет важную роль в механизме развития отека легких, отеков при застойной сердечной недостаточности и др. При заболеваниях почек, печени, сердечной недостаточности, при голодании отеки имеют генерализованный характер, их патогенез сложен и включает многие факторы.
Онкотические (гипоальбуминемические) отеки.
Такие отеки развиваются при голодании (кахектические); печеночной недостаточности из-за снижения синтеза альбуминов: заболеваниях почек, сопровождающихся проте-инурией, особенно при нефротическом синдроме, когда потеря белка в сутки превышает 3 г и может достигать 80 г. Ведущим звеном патогенеза таких отеков является снижение онкотического давления в сосудистом русле. При этом уменьшается эффективная онкотическая сила всасывания, увеличивается фильтрация жидкости из капилляров и уменьшается ее резорбция в капилляры. Это влечет за собой уменьшение ОЦК (гиповолемию), ослабление кровотока, активизацию ренин-ангиотензин-альдостероновой системы. Развивается вторичный альдостеронизм, повышается секреция АДГ, реабсорбция ионов Na+ и воды в почках. Задержка воды направлена на восстановление ОЦК, но так как при этом онкотическое давление крови и эффективная онкотическая сила всасывания не повышаются, то жидкость в сосудистом русле не удерживается и снова перемещается в ткань, где нарастает отек. Сохраняющаяся гиповолемия, несмотря на избыток воды в организме, будет продолжать стимулировать ренин-ангиотензин-альдостероновую систему. Развивается порочный круг в патогенезе онкотического отека, который может быть устранен путем нормализации онкотического давления крови и устранения причин гипоальбуминемии.
Следует заметить, что по мерс развития онкотических отеков присоединяется лимфатическая недостаточность (сдавление лимфатических сосудов отечной жидкостью, перегрузка лимфооттока), которая усугубляет картину. При этом отеки распространяются по всему телу, отекают все органы, развиваются водянки, значительно увеличивается масса тела. Такой генерализованный отек носит название «анасарка».
Сердечные, или застойные отеки.
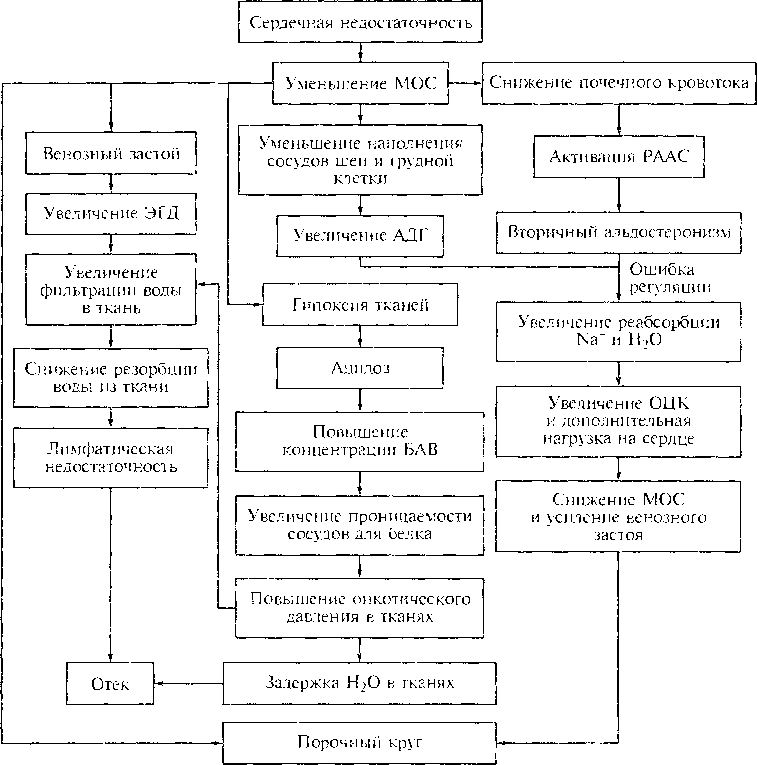
Эти отеки развиваются у больных с сердечной недостаточностью. При левожелудочковой недостаточности может развиваться кардиогенный отек легких, при правожелудочковой недостаточности отекают, как правило, нижние конечности, туловище, может наблюдаться асцит. Патогенез таких отеков, с одной стороны, включает в себя венозный застой, увеличение эффективного гидростатического давления, повышение фильтрации из капилляров и снижение резорбции в капиллярах, развитие динамической лимфатической недостаточности из-за перегрузки лимфооттока и спазма лимфатических сосудов, с другой стороны — уменьшение МОС, ослабление кровенаполнения артериальных сосудов шеи и грудной клетки, уменьшение почечного кровотока и активизация ренин-ангиотензин-альдостероновой системы, повышение секреции АДГ, уменьшение диуреза приводят к увеличению ОЦК (рис. 9.4).
Но из-за ослабления насосной функции сердца задержка воды лишь усиливает венозный застой, является дополнительной нагрузкой для сердца и может привести к еще большему ослаблению его сократительной способности. Как и в случае с онкотическими отеками возникает порочный круг по механизму «ошибочного регулирования».
В патогенез застойных отеков может включиться и мембранный фактор, так как на фоне циркуляторной гипоксии тканей могут появиться биологически активные вещества, повышающие проницаемость сосудов, а также онкотический фактор, так как снижается синтез альбуминов в печени. Коррекция застойных отеков у больных с сердечной недостаточностью должна быть направлена на восстановление сократительной способности сердца и нормализацию МОС.
Патогенез отеков.
В патогенезе отеков при гломерулонефрнте, острой и хронической почечной недостаточности (олиганурическая стадия) играют роль несколько факторов: уменьшение величины клубочковой фильтрации из-за уменьшения числа функционирующих нефронов, активизации ренин-ангиотензин-альдостероновой системы в результате нарушения почечного кровотока со всеми перечисленными ранее последствиями, а также повышение проницаемости сосудов. Особенностью таких почечных отеков является их локализация преимущественно на лице. В тяжелых случаях отеки становятся генерализованными, на фоне анурии у больных могут развиться отеки легких, мозга. Патогенез отеков и асцита при циррозе печени связан с повышением гидростатического давления в системе vena porta. часто и в системе нижней полой вены, что приводит к увеличению фильтрации жидкости в ткани (эффективное гидростатическое давление больше эффективной осмотической силы всасывания); снижением альбуминов в крови (цирроз сопровождается печеночной недостаточностью), а значит уменьшением эффективной онкотической силы всасывания; вторичным альдостеронизмом, обусловленным уменьшением ОЦК.