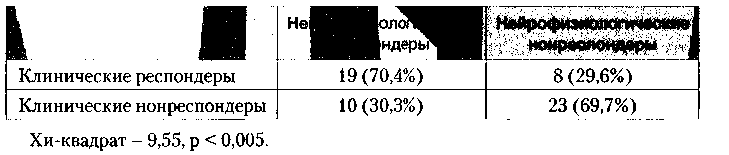В статье представлены результаты исследования влияния биологической обратной связи (БОС), направленной на изменение электрической активности мозга (а-Ө-тренинг), на состояние пациентов с тревожными расстройствами, резистентными к психофармакотерапии. Результаты исследования показали, что метод БОС эффективен при тревожно-депрессивном расстройстве и изолированной фобии. Показано также, что увеличение мощности α-ритма в левой затылочной области у правшей коррелирует со снижением уровня тревоги. По полученным нами данным, можно предположить, что нейрофидбек является эффективным методом преодоления терапевтической резистентности у больных с тревожными расстройствами. Особенно это касается тревожной депрессии и специфических изолированных тревожных расстройств. Социальная фобия нуждается, по-видимому, более в психотерапевтическом воздействии, чем в терапии БОС.
Последние 20 лет характеризуются значительными успехами в области терапии тревожных расстройств (ТР). Помимо применявшихся ранее препаратов бензодиазепинового ряда и трициклических антидепрессантов, лекарственная терапия ТР осуществляется с применением селективных ингибиторов обратного захвата серотонина (СИОЗС) и антипсихотиков нового поколения. Однако фармакотерапия не решает всех проблем в лечении ТР. Эффективность психотропных препаратов достигает 70-75% (Rickels К., Downing R., et al.,1993; Tollefson G. D., et al., 1993; Berti C., et al., 1995), а в случае обсессивно-компульсивных расстройств — 20-50% (С.Н. Мосолов, 2005). Актуальность проблем терапии ТР связана с высоким распространением расстройств тревожного спектра среди населения. Так, по результатам ряда эпидемиологических исследований, клинически значимую тревогу испытывают от 1 % (Kielholz Р, Adams С., 1989) до 2-4,7 % (Vollrath М., Angst J., 1989) или даже 3-6% (Holmberg G., 1989) населения.
В настоящее время активно ведется поиск объективных ЭЭГ-признаков тревожности (John E.R.,1989; Enoch М.А.с соавт. 1995; Bruder G. Е с соавт. 1997). Несмотря на наличие множества исследований, посвященных анализу ЭЭГ-признаков тревожности у животных и человека (Gray J. А., 1982; Hinrichs Н., с соавт. 1992; Enoch М. А. с соавт. 1995; Herrman W. М., с соавт. 1996; Knott V.J. с соавт. 1996; Knott V.J. с соавт. 1997), единая точка зрения на их роль как индикаторов этого состояния до настоящего времени не выработана.
Существует мнение (Свидерская Н.Е. с соавт., 2001), что важную роль в нейропсихологической структуре тревожности у человека играет парието-темпоральная область левого полушария (у правшей). Есть данные, что при патологии этой зоны ведущим признаком эмоциональных сдвигов является тревога с тенденцией к сочетанному нарушению вербального мышления (Брагина Н. И., Доброхотова Т. А., 1981), в то время как поражение гомологичной области правого полушария вызывает более разнообразные проявления (страх, тоска, ужас на фоне выраженных вегетативных сдвигов) (Шмарьян А. С., 1949). Однако, по мнению Л. Р. Зенкова (1996), полученных данных недостаточно для того, чтобы говорить о выявлении нейрофизиологических коррелятов психопатологическим феноменам.
Нейрофидбек — метод терапии, основанный на применении биологической обратной связи по нейрофизиологическим параметрам, занимает в этом перечне ещё не вполне обозначенное место. Этот метод, возможно, является перспективным для оптимизации лечения резистентных больных.
Целью настоящего исследования являлась оценка эффективности применения биологической обратной связи (БОС) — метода, основанного на попытке изменения визуализированных физиологических параметров, в частности, нейрофидбека (НБОС), где в качестве управляемого параметра была избрана электрическая активность мозга, в терапии тревожных расстройств. Основная исследовательская гипотеза заключалась в том, что вне зависимости от того является ли методика исключительно психотерапевтической или в её основе лежат биологические явления, комбинированная терапия с применением БОС будет оказывать терапевтическое воздействие у больных с тревожными расстройствами.
Материалы и методы исследования
Клинические критерии включения больных в исследование были следующими: выраженность тревоги — 20 и более баллов по шкале Гамильтона для оценки тревоги (НАМА); диагноз по МКБ-10: F40.1 -социальная фобия, F40.2 — специфическая изолированная фобия, F41.2 — смешанное тревожное и депрессивное расстройство (ТД), F42.0 (1, 2) — обсессивно-компульсивное расстройство (ОКР); праворукость; резистентность к проводимой стандартной психофармакотерапии (под резистентностью понималось отсутствие ожидаемого эффекта при проведении как минимум двух курсов адекватной психофармакотерапии (в рекомендованных терапевтических дозировках и продолжительностью не менее 4 недель каждый) препаратами различных химических классов (Авруцкий Г. Я., Недува А. А., 1988)); затяжной характер течения: длительность ведущей симптоматики составляла не менее 4 месяцев.
Пациенты не включались в исследование (или исключались из него в процессе лечения) в следующих случаях: клинически значимые черепно-мозговые травмы и хронические соматические заболевания; психоз; очаговая неврологическая симптоматика; низкий судорожный порог, регистрируемый на ЭЭГ, в том числе диэнцефальная и височная эпилепсия, в структуру приступа которых входят элементы панической атаки; патология щитовидной железы (гипо- и гипертиреоз), протекающая с симптомами, напоминающими тревожные расстройства, панику (при подозрении на патологию больные направлялись на консультацию к эндокринологу); гипертоническая болезнь, протекающая с кризами, имитирующими симптоматику тревожного приступа, аритмии (в частности, пароксизмальная тахикардия), пролапс митрального клапана; злоупотребление стимулирующими препаратами (кофеин, амфетамин, кокаин, аноректические средства); изменения в приеме психофармакологических препаратов в течение 3 недель до включения в исследование и во время терапии. В качестве объекта исследования были избраны пациенты с неэффективной анксиолитической фармакотерапией.
Отчасти это было сделано для достижения большей наглядности исследования (у таких больных уже исчерпаны ресурсы фармакотерапии). Кроме того, сама методика требует определённых усилий со стороны пациента, и добиться осознанного согласия на лечение проще у человека, который лишён надежды на «быструю и лёгкую помощь извне».
В общей сложности по указанным критериям было обследовано 88 больных. Однако 28 из них выбыли из исследования досрочно и не были включены в окончательный анализ. Причины досрочного выбывания этих больных из исследования анализируются ниже. Курс терапии закончили и были включены в исследование 60 пациентов (17 мужчин и 33 женщины). Согласно принятой клинической систематике (МКБ-10) состояния квалифицировались как ОКР (F42.0 (1,2)) в 16 случаях(27%), Социальная фобия (F40.1) в 16 случаях (27 %), Смешанное тревожное и депрессивное расстройство (F41.2) в 14 случаях (23 %) и Специфические изолированные фобии (F40.2) в 14 случаях (23%). Среди них было 17 мужчин (20,2%) и 43 женщины (70,8 %) в возрасте от 17 до 47 лет (средний возраст -27,75+ 0,3).
В соответствии с целью исследования все больные распределялись в 3 терапевтические группы:
- 20 больных, получавших лечение БОС и психофармакотерапию (БОС+ФТ). Эта группа включала в себя 6 (30%) больных с ОКР, 4 (20%) с социальной фобией, 5 (25%) с тревожнодепрессивными расстройствами и 5 (25 %) с изолированными фобиями. Группа состояла из 14 женщин и 6 мужчин в возрасте от 19 до 47 лет.
- 20 больных, получавших только лечение НБОС, после отмены психофармакотерапии (БОС). В числе данных больных у 5 (25 %) было диагностировано ОКР, у 6 (30 %) — социальная фобия, ещё у 5 (25%) — тревожно-депрессивное расстройство и у 4 (20%) — изолированная фобия. Группа состояла из 15 женщин и 5 мужчин в возрасте от 17 до 43 лет.
- 20 больных, получавших в качестве лечения те же препараты, что и прежде, вместе с БОС-плацебо (ПБОС+ФТ). В группе были представлены следующие диагностические категории: 5 (25%) больных с (ОКР), 6 (30%) с социальной фобией,
- (20%) с тревожно-депрессивными расстройствами и 5 (25%) с изолированными фобиями. В этой группе было 14 женщин и 6 мужчин в возрасте от 18 до 46 лет.
Очевидная с методической точки зрения мысль о формировании четвёртой группы из больных, получающих только БОС-плацебо терапию, была отвергнута по этическим соображениям.
Распределение в группы осуществлялось рандомизированно. Процедура рандомизации происходила следующим образом. После установления диагноза пациентам присваивались номера от одного до трёх в каждой из четырёх диагностических групп. В зависимости от номера пациент случайно попадал в первую (БОС+ФТ), вторую (БОС) или третью (БОСП+ФТ) терапевтическую группу.
Те пациенты (28 человек), которые были рандомизированы, но не закончили курс лечения, не были включены в окончательный анализ эффективности. Причём 6 больных были из группы БОС+ФТ, 13 — из группы БОС и 9 — из группы БОСП+ФТ (статистически значимы только различия между первой и второй терапевтическими группами, р<0,05). Наибольшее число среди отказавшихся продолжать лечение было в группах больных ОКР и ТД (10 и 9 пациентов соответственно), больные со специфическими изолированными фобическими расстройствами отказывались продолжать лечение в 6 случаях, среди больных с социальной фобией не завершили курс 3 человека.
Клиническое исследование больных заключалось в их расспросе с одновременной стандартизованной и квантифицированной регистрацией клинических симптомов на основе нескольких формализованных шкал-опросников. Среди последних применялись шкала Гамильтона для оценки тревоги (НАМА), шкала Гамильтона для оценки депрессии (HAMD), шкала Sheehan (Sh) для оценки выраженности паники, тревоги ожидания и шкала-самоопросник SCL-90 (Derogatis L.R., Cleary Р. А., 1977). Динамика общего клинического впечатления под влиянием терапии оценивалась по шкале глобальной клинической оценки CGI (Clinical Global Impression Scale, 1976). Терапевтические группы оказались сопоставимы по основным клинико-демографическим параметрам.
Критериями эффективности для итоговой оценки результатов лечения являлись 50 % редукция суммарного рейтинга баллов шкалы Гамильтона для оценки тревоги и достижение показателей «выраженное улучшение» или «существенное улучшение» по шкале CGI. Выраженность психопатологической симптоматики регистрировалась дважды (до начала терапии и на двадцатом занятии, то есть на 28-й день терапии). Оценка эффективности курса терапии проводилась на 28-й день.
Для изучения и модификации биоэлектрической активности головного мозга применялась система, представленная интерфейсом I-33R. Обработка сигналов проводилась с помощью программного обеспечения «Boslab», версия 2001 г., разработанного Институтом медицинской и биологической кибернетики СО РАМН. Применялось биполярное отведение ЭЭГ-сигнала, активные электроды у правшей устанавливались в отведениях Fd-Od (правый лоб — правый затылок) или Fd-Pd (правый лоб -правое темя), референтный электрод фиксировался на мочке уха. В процессе записи энцефалограммы проводился подсчёт мощности a-активности. Ежедневно больному снималась ЭЭГ в биполярных отведениях в одно и то же время суток и при стандартной ситуации. Запись проводилась в состоянии покоя в течение 2 минут. Затем проводились собственно тренировочные сессии (обычно 2-3 за сеанс). Достижение условно позитивного психофизиологического состояния (прирост мощности 0 в левой затылочной области) подкреплялось хорошо различимым звуковым сигналом. В группе ПБОС+ФТ уровнем сигнала позитивного подкрепления вместо мощности a-активности свободным образом управлял исследователь, давая тем самым больному ложное представление об условно одобряемом состоянии. Процедура проводилась в стандартных условиях. Курс включал 20 часовых сеансов, проводившихся 5 дней в неделю (всего — 4 недели).
Пациент считался респондером по нейрофизиологическим параметрам в том случае, если во время последнего сеанса регистрировалось среднее значение интенсивности a-активности на 20% больше зарегистрированного на первом сеансе.
Статистическая оценка полученных данных проводилась путём сравнения результатов трёх терапевтических групп, с одной стороны, и четырёх диагностических групп, с другой.
Поскольку большинство изучаемых показателей не было подвержено нормальному распределению, основными статистическими методами, использованными в работе, были непараметрические методы. Применялись следующие тесты: критерий знаков, U-критерий Манна-Уитни, критерий хи-квадрат, коэффициент корреляции Спирмена. Кроме того, для выявления предикторов эффективности терапии использовались процедуры прямой и обратной пошаговой регрессии.
Результаты исследования
Шкала CGI позволяет оценивать состояние больных вне зависимости от характера патологического состояния. В нашем случае, где в терапевтических группах представлены пациенты с 4 основными диагностическими категориями, этот инструмент был необходим для первичной оценки результатов проведённого лечения. В таблице 1 представлена сравнительная эффективность терапии по шкале CGI-I.
Из данной таблицы видно, что наибольший терапевтический успех наблюдался в группе с комбинированной терапией, а наименьший -в группе, где больные получали психофармакотерапию и ложный БОС-тренинг, где отмечались даже ухудшения.
Динамика тревожной симптоматики при применении комбинированной терапии, то есть при проведении БОС-тренингов у тех больных, которым была оставлена их прежняя недостаточно эффективная ПФТ, имела ряд особенностей. Во время проведения первого тренинга НБОС некоторая часть пациентов в той или иной степени испытывала тревогу, беспокойство. Такое состояние может быть объяснено непривычностью ситуации, в которую попадал пациент и частичной сенсорной депривацией, что значимо для больных с тревожными расстройствами.
Терапевтическое действие обнаруживалось уже после первой процедуры и проявлялось, в первую очередь, развитием собственно анксиолитического эффекта, который сохранялся от нескольких часов до суток. Большинство больных рассказывали, что весь день после первой процедуры ощущали «умиротворённость», «расслабленность». Отчётливое клиническое улучшение отмечалось обычно после 7-10 процедур.
Вторая терапевтическая группа реагировала на лечение иначе -изначальная тревожная симптоматика нередко усиливалась: больные жаловались на бессонницу, постоянное чувство напряжения и утяжеление своего состояния. Описанный феномен может быть объяснён формированием синдрома отмены у пациентов с длительным фармакотерапевтическим стажем. Причем, по свидетельству некоторых исследователей, это может относиться даже к курсовому применению малых доз бензодиазепинов. К наиболее часто встречающимся признакам синдрома отмены транквилизаторов, как известно, относятся желудочно-кишечные расстройства, повышенное потоотделение, тремор, сонливость, головокружения, головные боли, непереносимость резкого звука и запаха, шум в ушах, деперсонализационные ощущения, а также упомянутые раздражительность, беспокойство, бессонница. Возможно также, что ухудшение состояния у этих больных было связано не только с синдромом отмены, но и с серьёзной психотравмой — больные, ранее подолгу получавшие психофармакотерапию и привыкшие полагаться на неё, были оставлены без лечения препаратами на wash-out (отмывочный) период, после чего получали только терапию БОС. С учётом того, что за время болезни у многих из них сформировалось требовательно-зависимое, даже потребительское отношение к окружающему миру, тренинги шли с большим трудом, пациенты быстро уставали, ухудшалось внимание, терялся интерес к лечению. Оптимизм и уверенность в своих силах формировались с большим трудом, как правило, после 15-17 процедур. С другой стороны, даже мимолётный успех в процессе тренинга у пациентов этой группы сопровождался значительным улучшением состояния. В группе с монотерапией БОС отмечались два случая незначительного ухудшения.
Динамика клинического состояния у пациентов третьей терапевтической группы первые две недели лечения была такая же, как и у пациентов первой группы: основные симптомы дезактуализировались, улучшались настроение и аппетит. Однако уже к 12 занятию у большей части больных состояние вновь утяжелялось, причём у 2 -до отметки «существенное ухудшение» по шкале CGI. Формирование этой группы вызвало наибольшее затруднение у исследователя, и было бы вообще неосуществимо, если бы не возможность работать с больными, находившимися на стационарном лечении. Даже в тех ситуациях, когда изменения в психическом статусе требовали от лечащих врачей изменений в назначениях, как правило, удавалось добиться взаимопонимания.
Относительно высокие показатели общей эффективности во всех терапевтических группах свидетельствуют о большом влиянии психотерапевтического компонента БОС у больных с ведущей тревожной симптоматикой.
На основании шкалы CGI-I уточним, за счёт каких диагностических групп формировался общий показатель эффективности в группах. На рисунке 1 приведена сравнительная эффективность видов терапии в различных диагностических группах.
Из рисунка видно, что наибольшая эффективность наблюдалась у больных с социальной фобией. Однако эти больные реагировали хорошо вне зависимости от того, применялась ли истинная биологическая связь или нет. На втором месте находится изолированное тревожное расстройство и тревожно-депресивное расстройство, которые реагировали приблизительно одинаково (изолированное тревожное расстройство лучше реагировало на комбинированную терапию, чем на монотерапию БОС, в то время как тревожно-депрессивное расстройство никаких предпочтений в этом смысле не демонстрировало). Пациенты с ОКР положительно реагировали на предложенную терапию только в группе с комбинированной терапией (БОС+ФТ). Из 6 больных группы БОС+ФТ с ОКР только 2 были признаны респондерами.
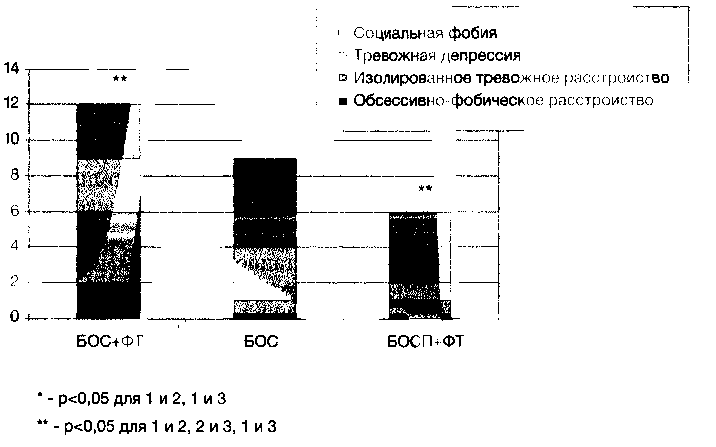
Рис. 1. Сравнительная эффективность различных видов терапии у больных с тревожными расстройствами (количество респондеров по шкале CGI-I)
В целом, эффективность терапии группе с монотерапией БОС была, как и ожидалось, ниже, чем в первой: ни один из пяти больных с обсессивно-фобическим расстройством не ответил на терапию, а в группе пациентов с изолированным тревожным расстройством только один из четырёх был признан респондером. Чуть лучше обстояло дело у больных с диагнозом «Тревожная депрессия” — заметное улучшение состояния было отмечено в 60 %. Наилучшим образом дело обстояло в группе «Социофобия» — респондерами были признаны свыше 83% больных. Средняя эффективность в группе — 45%.
Что касается эффективности терапии в третьей терапевтической группе при различных диагностических категориях, результаты здесь были, как и прогнозировалось, низкими. Во всей группе оказалось только 30 % респондеров. Однако, то обстоятельство, что присоединение психотерапии, каковой, отчасти, и является БОС-плацебо, столь значимо влияет на течение тревожных расстройств, резистентных к фармакотерапии, говорит о необходимости психотерапевтической помощи больным с тревожными расстройствами вообще, и с социальной фобией в особенности.
Таким образом, больные с ОКР позитивно отвечали на терапию только в группе комбинированной терапии. В двух других терапевтических группах респондеров среди пациентов с этим заболеванием не было.
Статистически значимыми оказались различия между количеством респондеров с изолированным тревожным расстройством в первой и второй и первой и третьей терапевтических группах (комбинированная терапия БОС+ФТ и монотерапия БОС, а также комбинированная терапия БОС+ФТ и БОСП+ФТ) (р<0,05). Различия между числом респондеров по другим диагностическим подгруппам не достигали статистической значимости (наблюдалась только тенденция к значимости), однако суммирование результатов терапии в каждой из терапевтических групп сделало различия между ними значимыми. В частности, между числом респондеров в группе с комбинированной терапией и двумя другими группами, а также между группами с истинным и ложным БОС отмечены существенные различия (р<0,05), что позволяет говорить о доказанной большей эффективности терапии БОС+ФТ по сравнению с фармакотерапией и плацебо-эффектом БОС+ФТ. Для нас наиболее интересными кажутся различия между показателями эффективности во второй и третьей группах, где по диагностическим подгруппам «Тревожная депрессия» и «Социальная фобия» формируется статистическая значимость большей эффективности монотерапии БОС по сравнению с БОС-плацебо (в составе комбинированной терапии с лекарствами).
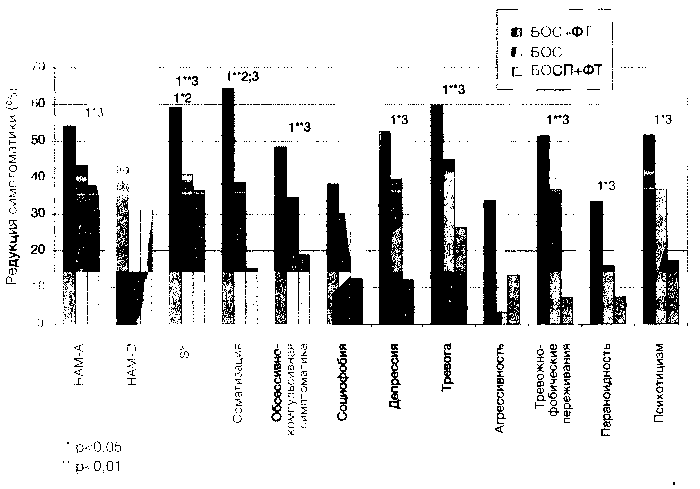
Другие шкалы, использовавшиеся в работе, позволяют уточнить, какая именно симптоматика и в каком объёме подвергалась трансформации в процессе лечения (для большей наглядности представим полученные данные в виде графика (см. рис. 2).
Из рисунка 2 видно, что в группе БОС+ФТ отмечалась наибольшая редукция всей симптоматики. Изолированное применение БОС давало второе по выраженности облегчение состояния почти по всем, кроме объективно регистрируемой тревоги — HAMD — исследуемым параметрам. Группа, в которой применялась комбинация ПФТ и ложного
БОС-тренинга, реагировала слабее всего. Для установления эффективности собственно БОС интересны данные, полученные при оценке трёх подшкал самоопросника — «Соматизация», «Депрессивность» и «Тревожно-фобические переживания», при этом разница в редукции этой симптоматики между 2-й и 3-й терапевтическими группами была статистически значимой (р<0,05).
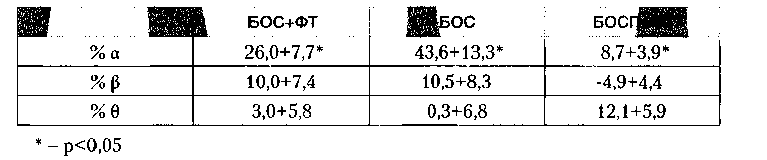
Помимо клинического аспекта, нас интересовали изменения нейрофизиологической активности в процессе терапии БОС по электрической активности мозга. В компьютерном протоколе тренинга оценка данных проводится на основании ряда нейрофизиологических параметров, в частности, мощности а, (β и Ө активности головного мозга пациента (проводившийся тренинг был направлен на увеличение мощности а). Абсолютные изменения этих параметров малоинформативны в связи с тем, что исходные данные у всех пациентов различны. Для оценки изменений, происходящих в мозге, предложено использовать величины, получаемые при определении степени изменения мощностей. Иными словами, данные, получаемые на последнем тренинге, вычитаются из исходных показателей, после чего определяется процентная доля прироста или снижения активности в данном частотном диапазоне. Результаты, полученные при анализе полученных данных, представлены в таблице 2.
Из таблицы видно, что наибольшая прибавка мощности а отмечается во второй терапевтической группе, где истинная биологическая обратная связь применялась без прикрытия ПФТ. Возможно это связано с тем, что применение ПФТ в первой терапевтической группе тормозило развитие изменений электрической активности мозга. Значимых различий по остальным параметрам выявить не удалось, хотя интересно отметить прибавку Ө-активности в 1-й и 3-й терапевтических группах при полном отсутствии изменений во 2-й. Несмотря на отсутствие значимости различий по данному показателю, имеющаяся тенденция может обладать серьёзным потенциалом в вопросе теоретического определения процессов, происходящих в мозге при проведении БОС-тренингов без фармакотерапевтического прикрытия.
Таким образом, мы можем говорить о принципиальной разнице между влиянием на нейрофизиологическую активность мозга реального тренинга и его психотерапевтической симуляции.
Можно также предположить, что нейробиофидбэк, направленный на увеличение мощности а у пациентов с тревожными расстройствами, резистентными к ПФТ, приводит к её увеличению. Психотерапевтическое воздействие оказывает аналогичное, но менее выраженное действие, а комплексная терапия снижает процесс синхронизации нейрофизиологической активности на уровне a-диапазона, однако даёт некоторый прирост на уровне Ө-диапазона.
Возможно, именно с этим связано то, что два случая улучшения при ОКР наблюдались именно в первой терапевтической группе. Для лечения больных с социальной фобией, по-видимому, требовалось не столько увеличение мощности α, сколько снижение β и увеличение Ө-активности.
С практической точки зрения, наибольший интерес представляет связь между изменениями нейрофизиологической активности и эффективностью терапевтического вмешательства, отражённый в таблице 3.
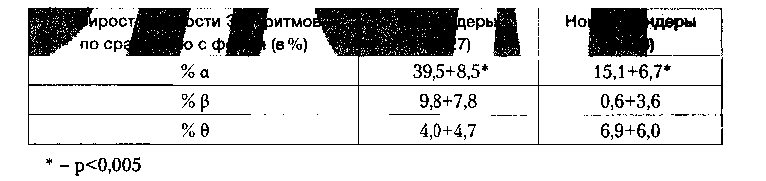
Таблица 3. Динамика нейрофизиологических параметров ЭЭГ в зависимости от терапевтической эффективности
Видно, что у респондеров происходил по крайней мере в 2 раза больший, чем у нонреспондеров прирост мощности α ритма, при статистически неразличимом изменении мощности Ө ритма. Мощность β ритма в группе респондеров несколько увеличивалась, а у нонреспондеров оставалась на начальном уровне, но из-за высокой дисперсии данных эта тенденция не достигает статистически значимой степени. Несмотря на то, что изменение мощности 0 ритма не являлось статистически значимым, тем не менее необходимо отметить, что его мощность была выше у нонреспондеров.
Можно предположить, что прибавка мощности а у клинических респондеров свидетельствует о снижении уровня тревожности, которое соответствует полученным клиническим наблюдениям. Поведение Ө ритма у нонреспондеров заставляет предположить наличие у них другой, вероятно патологической, системы реагирования на α-стимулирующий тренинг.
Предположение о преимущественном реагировании на тренинг нейрофизиологической активности при некоторых из рассматриваемых нозологий рассматривается в таблице 4.
Из таблицы видно, что наибольший прирост α-активности наблюдается у больных с социальной фобией, наименьший — у пациентов с ОКР, больные с ТД и изолированным тревожным расстройством имели средние показатели прироста по этому параметру. Интересно, что аналогично выглядели клинические результаты эксперимента. Напомним, что в группе больных с социальной фобией было больше всего респондеров, среди пациентов с ОКР — меньше всего, а больные из двух остальных групп занимали промежуточное положение по клинической эффективности метода. Из-за большой дисперсии трудно говорить о реальном приросте β-активности, скорее речь идёт о тенденции её увеличения в группах «Тревожная депрессия», «Социальная фобия» и «Тревожное расстройство». В группе ОКР её прироста не наблюдается. Мощность 0 ритма значительно увеличивается в группе «Тревожное расстройство» и меньше — в группе «Социальная фобия». В остальных группах заметных изменений этого параметра нет.
Другими словами, чем выше прирост мощности Ө в диагностической группе, тем больше в ней клинических респондеров. Нейрофизиологическими респондерами, согласно данным литературы, признаются те пациенты, у которых прирост мощности Ө составил 20% и более. На основании этого признака мы сопоставили нейрофизиологическую и клиническую успешность во всей выборке (табл. 5).
Приблизительно 70 % нейрофизиологических респондеров оказывались и клиническим «респондерами». И, наоборот, у нейрофизиологических нонреспондеров часто отсутствовал и эффект. Таким образом, с большой долей вероятности можно говорить о наличии взаимосвязи между клинической и нейрофизиологической успешностью терапии. По нашим наблюдениям, эти явления происходят параллельно. Нейрофизиологические нонреспондеры, оказавшиеся в группе клинических респондеров, по-видимому, являются результатом психотерапевтического воздействия метода и принадлежат, по большей части к диагностической группе «Социальная фобия”. Существование клинических нонреспондеров при нейрофизиологической успешности данных пациентов заставляет подозревать наличие незадействованных в исследовании механизмов, влияющих на уровень тревоги у пациента.
Обсуждение
Таким образом, результаты проведённого исследования показали, что биообратная связь, основанная на изменении электрической активности мозга (НБОС), в качестве монотерапии обладает анксиолитическим и антидепрессивным действием, является достаточно эффективным методом преодоления резистентности при тревожных расстройствах и не вызывает значимых побочных явлений.
В действии метода удалось выделить несколько этапов. В частности, в группах с комбинированной терапией (БОС+ФТ) и изолированной терапией можно выделить седативный этап, развивавшийся в течение 1-й недели терапии и длящийся не более недели, а также собственно анксиолитический этап, проявляющийся к середине 3-й недели. У тех больных, к которым применялся ложный тренинг, седативный эффект развивался несколько раньше и истощался в сроки, аналогичные таковым при применении реального БОС, а анксиолитический — не развивался вообще.
По-видимому, седативный эффект является следствием психотерапевтической интервенции, возникает на 1-й неделе терапии и обычно истощается ко 2-й. Описание аналогичного явления можно найти в работе Скока А. Б. (1999). По мнению Л. Р. Зенкова (1996), при повышении уровня страха или беспокойства амплитуда a-ритма уменьшается вплоть до полного исчезновения за счёт уплощения спектра с равномерным распределением мощности по всем основным частотам. Полученная в процессе эксперимента картина подтверждает это наблюдение.
Кроме того, результаты исследования подтверждают мнение Н.Е. Свидерской (2001) о связи электрической активности левого полушария с уровнем тревоги, вместе с тем, по-видимому, более значимыми для развития тревоги являются изменения не в париетотемпоральной, а в окципитальной области.
Основная проблема данного исследования заключается в недостаточной выборке и малой статистической мощности исследования, что не позволяет с большей достоверностью говорить об изменениях электрической активности мозга при тех или иных изменениях психического состояния. Кроме того, на качестве работы ощутимо сказалось отсутствие электроэнцефалографического картирования, которое могло бы позволить получить более точное представление о процессах, происходящих в мозге до проведения тренингов и после лечения.
Литература
- Брагина Н. И., Доброхотова Т. А., Функциональные асимметрии у человека. М.: Медицина, 1988, с. 287.
- Зенков Л. Р., Падалко В.В, Лавдовский В. С., Тонха Д. К. Нейрофизиологическое исследование премедикации предоперационного стресса дроперидолом//Стресс и его патогенетические механизмы. — «Штиинца», 1973, с. 74-76.
- Зенков Л. Р., Клиническая энцефалография с элементами эпилептологии М.: Медицина; 1996.
- Мосолов С. Н. Обсессивно-компульсивное расстройство (диагностика, клиника терапия)//М., 2005, с. 36.
- Свидерская Н.Е., Прудников В.Н., Антонов А. Г. Особенности ЭЭГ-признаков тревожности у человека//Журнал высшей нервной деятельности, 2001, т. 51, № 2, с. 158-165.
- Скок А. Б. Применение БОС у больных с алкоголизмом. Диссертация канд. мед. наук. Сибирское отд. РАМН, 1999.
- Шмарьян А. С.; Мозговая патология и психиатрия. Т. 1.М. Медгиз.- 1949, с. 352.
- Berti С., Doogan D. Р, Scott N. R., DinanT. G. Sertraline in the treatment of depressive disorders associated with anxiety//J. Serotonin res., 1995, № 2, p. 151-170.
- Bruder G. E, Fong R., Tenke С. E. et al. Regional brain asymmetries in major depression with or without an anxiety disorder: a quantitative electroencephalographic study//Biol. Psychiatry, 1997, Vol. 41, № 9, p. 316-336.
- Davidson R. J. Anterior cerebral asymmetry and the value of emotion//Brain and Cognition, 1992. Vol. 20, p. 125-151.
- Enoch M. A., Rohrbaum J.N., Davis E. Z. et al. Relationship of genetically transmitted alpha EEG traits to anxiety disorders and alcocholism//Amer.J. Med.genet. 1995, Vol. 60, № 5, p. 400-409.
- Gray J. A. Multiple book review of the neuropsychology of anxiety: an enquiry into the function of the septo-hippocampal system//Behav. and brain sci. 1982, Vol. 5, № 3, p. 469-534.
- Herman W. M., Winterer G. Electroencephalography in psychiatry current status and outlook//Nervenarzt, 1996, Vol. 13, № 5, p. 348-359.
- Hinrichs H., Machlcidt W. Basic emotions reflected in EEG-coherences//Intern.J. psychophysiol, 1992, Vol. 13, № 3, p. 224-232.
- Holmberg G. The nosologic specificity of panic disorder/Many faces of panic disorder/K. Achte et al. (Eds)/Psychiat. Fennica, 1989, p. 53-58.
- John E. R. The role of quantitative EEG topographic mapping or «neurometries» in the diagnosis of psychiatric and neurological disorders//J. Electroencephalograph, and clin. neurophysiol., 1989, Vol. 73, p. 2-4.
- Kielholz P., Adams C., (Eds) Preface/Panic anxiety states//Koln. — 1989, p. 7.
- Knott V.J., Bakish D., Lusk S. et.al. Quantitative EEG correlates of panic disorder// Psychiatry Res. 1996, Vol. 13. №.l, p. 31-39.
- Knott V.J., Bakish D., Lusk S., Barkley J. Relaxation-induced EEG alteration in panic disorder patients//J. anxiety disord. 1997. Vol. 11. № 4. p. 365-376.
- Peniston E. G., Kulkosky PJ. Alpha-theta brainwave training and beta endorphin levels in alcoholics//Alcoholism: clinical and experimental research. 1989. 13. p. 217-279.
- Peniston E.G., Kulkosky P.J. Alcoholic personality and alpha-theta brainwave training// Medical psychotherapy: An International Journal, 1990, Vol. 3. p. 37-75.
- Rickels K., Downing R., Schweizer E., Hassman H. Antidepressant for the treatment of generalized anxiety disorder//Arch. Gen. Psychiat., 1993, Vol. 56, p. 884-895.
- Tollefson G. D., Holman S. L., Sayler M. E., Potvin J. H. Fluoxetine, placebo and tricyclic antidepressants in major depression with and without anxiety features//J. Clin. Psychiatry, 1994, Vol. 55, p. 50-59.
- Vollrath M., Angst J. Outcome of panic and depression in seven-year follow-up: results of the study//Acta Psychiatr. Scand., 1989, Vol. 80, № 6, p. 591-596.