В открытое сравнительное исследование было включено 90 больных с биполярным аффективным расстройством с частыми рецидивами (34 мужчин и 56 женщин, средний возраст — 40,8± 12,7 года). В группе вальпроата натрия (ВН) было 29 больных, ламотриджина (ЛАМ) -31, топирамата (ТПМ) — 30. Оценка профилактической эффективности исследуемых препаратов проводилась по шкалам YMRS, CGI-BP, MADRS, GAF. Результаты исследования показали, что все препараты в целом сопоставимы по глобальной оценке эффективности, сокращают число обострений и способны предотвращать развитие как маниакальных, так и депрессивных состояний. Глобальное функционирование по шкале GAF статистически значимо увеличилось во всех группах.
В группе ТПМ, однако, по сравнению с другими группами был ниже процент респондеров, больше процент выбывания пациентов из исследования, а средние сроки до прерывания терапии были короче. ВН и ТПМ превосходили ЛАМ по способности редуцировать маниакальную симптоматику. ЛАМ в большей степени, чем другие препараты, уменьшал выраженность депрессивной симптоматики. ТПМ же одинаково эффективно воздействовал на симптоматику обоих полюсов, не достигая выраженности редукции определенных кластеров аффективной симптоматики, характерной для ВН и ЛАМ. Наибольшее число побочных эффектов наблюдалось в группе ТПМ. ЛАМ оказался наиболее хорошо переносимым препаратом. Следует отметить, что большинство побочных эффектов во всех группах наблюдалось в начале исследования, т. е. на этапе наращивания дозировок.
Терапия биполярного аффективного расстройства (БАР) в последние годы является одной из наиболее широко обсуждаемых медицинских проблем. По данным эпидемиологических исследований, выполненных в разных странах, распространенность этого заболевания колеблется от 0,2 до 1,5% (Weissman М.М. с соавт., 1996). БАР поражает двоих из каждых ста человек в популяции (Weissman М. М. с соавт., 1996; Kessler R.C. с соавт., 1994).
Фазный (биполярный) характер аффективных и аффективнобредовых эпизодов с отчётливо выраженными ремиссиями, минимальная выраженность или отсутствие дефицитарной симптоматики характеризует пациентов, страдающих БАР, как наиболее трудоспособных и социально адаптированных, что определяет актуальность вторичной профилактики рецидивов.
Известно, что значительные успехи в области фармакопрофилактики БАР были достигнуты с началом применения солей лития (Baastrup Р.С., 1964). Было установлено, что соли лития, не вызывая инверсии депрессивной фазы, предупреждают развитие эпизодов мании. В связи с выраженной бимодальностью действия солей лития было предложено обозначить их терапевтический эффект как нормотимический (Schou М., 1968).
Несмотря на то, что карбонат лития до настоящего времени является традиционным препаратом для профилактики БАР, многолетний клинический опыт, подтвержденный многочисленными исследованиями (Maj М., 2000), выявил ряд недостатков, существенно ограничивающих возможности его применения. Так, у 42 %-64 % больных литий оказывается неэффективным (Solomon D. А., 1995). Особенно это касается больных с континуальным характером аффективных расстройств.
Вальпроат натрия (ВН) и карбамазепин стали альтернативой применению солей лития (Lambert Р. А., 1968; Okuma Т., 1973). Несмотря на широкое использование ВН, доказательных данных, показывающих его эффективность в качестве средства профилактической терапии БАР, удивительно мало. Его эффективность в качестве нормотимика показана в многочисленных открытых исследованиях (Calabrese J. R., Delucchi G.A., 1990; Calabrese J.R., с соавт., 1993; Sharma V. с соавт., 1993; Ghaemi S.N. и Goodwin F.K., 2001; Revicki D.A. с соавт., 2005 и др.). В ряде исследований, было показано, что спектр действия ВН аналогичен спектру лития, он в большей степени предотвращает развитие маниакальных фаз по сравнению с депрессивными (Calabrese J.R. с соавт., 1990; Мосолов С.Н., 1983,1991; 1996; Мосолов С.Н. с соавт., 1994; Bowden C.L. с соавт., 2000; Кузавкова М.В., 2001). Однако исследования последних лет показывают эффективность профилактической и купирующей терапии ВН также в отношении депрессивных фаз (Ghaemi S.N. с соавт., 2007, Davis L. L. с соавт., 2005; Winsberg М. Е. с соавт., 2001).
Антиконвульсант ламотриджин (ЛАМ), относительно недавно внесенный в группу нормотимиков, проявляет действие в отношении фаз обоих полюсов, хотя в отношении депрессий оно более выражено, чем в отношении маний (Bowden С. L. с соавт., 2001, Bowden С. L. с соавт., 2002, Bowden С. L. с соавт., 2003, Calabrese J. R. с соавт., 1999, Calabrese J.R. с соавт., 2003). С точки зрения доказательной медицины профилактическое действие ламотриджина считается подтвержденным только для предотвращения депрессивных фаз. Учитывая недостаточную доказательную базу его профилактического действия в отношении маний, он рекомендован к медицинскому применению для профилактики рецидивов БАР, в клинической картине которого преобладают депрессивные фазы.
В последнее десятилетие изучаются нормотимические свойства другого антиконвульсанта — топирамата (ТПМ). Однако число исследований этого препарата остается ограниченным, и касаются они, прежде всего, антиманиакальных свойств ТПМ. Специально спланированных исследований профилактических свойств этого препарата не проводилось. В то же время данные, полученные Chengappa K.N. с соавт., (1999) и McElroy S.L. с соавт. (2000) свидетельствуют о возможном наличии у него нормотимического действия. Однако в этих исследованиях изучение профилактических свойств ТПМ было вторичной задачей, и они включали крайне малочисленную группу пациентов. В то же время эти результаты позволяют определить ТПМ как перспективный препарат для профилактики БАР, который требует дополнительного изучения в спланированных исследованиях на большей выборке больных.
Все сказанное определяет актуальность изучения эффективности превентивного действия ЛАМ и ТПМ в сравнении с традиционно применяемыми нормотимиками при БАР, а также поиска клинических предикторов их эффективности.
По дизайну исследование было открытое сравнительное. Его длительность составляла 52 недели. В исследование включались амбулаторные и стационарные больные в возрасте от 18 до 65 лет, давшие добровольное согласие на участие в исследовании, с диагнозом по МКБ-10: биполярное расстройство (F31). Длительность заболевания к моменту начала профилактической терапии должна была составлять не менее 2-х лет. За год, непосредственно предшествовавший началу профилактической терапии, у больного должно было наблюдаться не менее двух эпизодов разного аффективного полюса.
Исследуемые препараты назначались в период очередного аффективного эпизода или в ремиссии, однако оценка эффективности профилактической терапии начиналась с 9-й недели с момента включения пациента в исследование. Такая точка отсчета была выбрана в связи с тем, что при оценке по шкале Общего Клинического Впечатления (CGI-BP-S) (Spearing М. К., 1997) именно с 9-й недели выраженность актуальной психопатологической симптоматики у больных, включенных в период острой фазы и в период ремиссии, становилась сопоставимой, и сформированные терапевтические группы не имели статистически значимых различий. Таким образом, период оценки профилактического эффекта составил 44 недели (308 дней).
Все исследуемые препараты применялись в соответствии с существующими рекомендациями. В группе ВН у больных, включавшихся в исследование в маниакальном состоянии, купирование мании происходило под контролем концентрации ВН в крови. В этом случае начальная доза составляла 20 мг на 1 килограмм веса, а концентрация ВН — от 70 до 125 мкг/мл. Коррекция дозы осуществлялась шагом по 250-500 мг/сут до 1500-2000 мг/сут. В последующем, после купирования острой маниакальной симптоматики доза корригировалась в зависимости от переносимости препарата. Для больных, включавшихся в исследование в период ремиссии, стартовая доза ВН составляла 150 мг/сут, с последующим ее увеличением каждые три дня на 150 мг до достижения дозы 600 мг/сут. Такой медленный темп наращивания дозировок ВН использовался в соответствии с инструкцией по профилактическому применению препарата для минимизации ранних побочных эффектов. В случае появления первых признаков рецидива в период профилактической терапии эта доза могла увеличиваться до максимально допустимой — 1800 мг/сут под контролем переносимости. Средняя по группе доза ВН, используемая для профилактической терапии, в настоящем исследовании составляла 750 мг/сут.
В группе ЛАМ начальная доза препарата составляла 25 мг/сут и увеличивалась на 25 мг еженедельно до достижения 200 мг/сут. При недостаточной эффективности терапии в последующем она могла увеличиваться до 400 мг в сутки.
В группе ТПМ начальная профилактическая доза препарата составляла 25 мг/сут в течение 1-й недели и еженедельно увеличивалась до 200 мг/сут, при недостаточной эффективности терапии доза могла увеличиваться до 600 мг в сутки.
В исследовании допускалось назначение снотворных средств небензодиазепиновой структуры (золпидем в дозе 10 мг или зопиклон в дозе 7,5 мг на ночь) для коррекции расстройств сна и анксиолитиков (за исключением алпразолама) при симптомах тревоги, которые могли привести к преждевременному прерыванию профилактической терапии.
В случае развития в период исследования острого аффективного или аффективно-бредового эпизода, его купирование проводилось в соответствии с общепринятыми методами. Так, для купирования актуальной депрессивной симптоматики в схему терапии включались антидепрессанты нового поколения, которые по завершении острого эпизода постепенно отменялись. В период маниакальной фазы при наличии выраженного психомоторного возбуждения или мании с психотическими симптомами в качестве купирующих средств использовались атипичные антипсихотики. После купирования симптоматики острого эпизода атипичные антипсихотики постепенно отменялись, и продолжалась монотерапия назначенным ранее нормотимиком.
Оценка состояния больных проводилась в момент включения в исследование, а затем ежемесячно. На плановых визитах, наряду с клиническим обследованием, проводилась оценка по трехбалльной врачебной шкале глобальной профилактической эффективности (экспертная оценка)и шкале Общего Клинического Впечатления -тяжести (CGI-BP-S).
Переносимость профилактической терапии оценивалась посредством регистрации всех нежелательных явлений (НЯ), возникавших в ходе исследования, а также с помощью Шкалы оценки побочного действия (UKU) (Lingjaerde О. с соавт., 1987), в которой наличие и степень выраженности каждого из них оценивается в баллах от 0 до 3. Все НЯ в случае их возникновения регистрировались при каждом визите и прослеживались до тех пор, пока не исчезали или не были адекватно объяснены.
Функционирование больных оценивалось с помощью шкалы Глобального функционирования (GAF) (Bodlund О., 1994). Кроме того, пациентам на каждом визите предлагалось заполнить короткую версию опросника ВОЗ (WHOQOL-BREF) (The WHOQOL Group, 1998). Оценка динамики по данным показателям проводилась на момент включения в исследование (фон — 9 неделя от момента включения в исследование), а затем на 13,25,37,52 неделях терапии. При возникновении рецидива между плановыми визитами проводилось дополнительное обследование и регистрация степени тяжести и длительности симптоматики в рецидивах. Результаты плановых осмотров больных регистрировались в формализованной клиникостатистической карте изучения средств нормотимического действия. На каждого пациента строился график течения заболевания с учетом длительности аффективных и аффективно-бредовых эпизодов, учитывалась их синдромальная квалификация.
Основным критерием эффективности профилактической терапии была оценка по трехбалльной врачебной шкале глобальной профилактической эффективности (экспертная оценка), которая позволяет учитывать все виды количественной редукции аффективной симптоматики (продолжительность, количество приступов, выраженность по амплитуде). Эффективность терапии по данной шкале оценивалась следующим образом:
- значительный эффект, полные респондеры (ПР) — полное или значительное (более чем на 75 %) сокращение суммарной длительности аффективной симптоматики и/или переход течения болезни на субклинический уровень;
- частичные респондеры (ЧР) — сокращение суммарной длительности и выраженности аффективных эпизодов от 50 % до 75% и/или переход аффективных расстройств на амбулаторный уровень, не требующий назначения других препаратов, госпитализации больного или выдачи больничного листа;
- незначительный эффект, нонреспондеры (HP) — сокращение суммарной длительности и выраженности аффективной симптоматики менее чем на 50% и/или увеличение степени тяжести течения аффективного расстройства, т. е. все остальные варианты динамики.
Для оценки профилактического эффекта сравнивалась длительность аффективной симптоматики в лечебном и контрольном периодах с определением ее доли в процентах, а также число перенесенных аффективных или аффективно-бредовых эпизодов за время наблюдения.
Для оценки глобальной эффективности терапии использовался анализ выживаемости (метод Каплана-Мейера), основанный на учете выбывания пациентов из исследования с последующим анализом причин прекращения терапии.
Статистический анализ проводился с использованием ППП Statistica версия 8.0. Анализ эффективности проводился с использованием LOCF-анализа (последнее наблюдение, продвинутое вперед) и СО-анализа (учет только пациентов, закончивших исследование). Учет безопасности препаратов и побочных эффектов проводился с помощью LOCF-анализа.
Терапевтические группы сравнивались между собой с помощью Медианного теста (для сравнения трех и более независимых групп) и теста Манна-Уитни (для парного сравнения независимых групп). Тест Вилкоксона применялся для сравнения показателей одной группы до начала терапии и по результатам терапии в исследовании (сравнение двух зависимых переменных). Методика ANOVA по Фридману использовалась для оценки динамики в группе за весь период исследования (сравнение трех и более зависимых показателей). Кроме того, использовалась методика ANOVA по Краскелу-Уоллису для сравнения показателей веса между группами в исследовании. Для оценки параметра прерывания терапии использовался анализ выживаемости с применением F-критерия Кокса (Реброва О. Ю., 2002, Боровиков В., 2003, Вуколов Э. А., 2004, Халявин А. А.,2008).
Для выявления прогностических факторов эффективности профилактической терапии и построения прогностической модели использовались следующие методы статистического анализа. Применялся ранговый коэффициент корреляции Спирмена. Категориальные переменные были приведены к бинарным моделям. Так, переменная ответа на терапию являлась зависимой, а нонреспондеры и частичные респондеры были закодированы как одна группа. Остальные переменные являлись независимыми. Семейный статус был закодирован в зависимости от наличия семьи в данный момент.
Таким образом, все пациенты, не имеющие семьи, как холостые, разведенные, вдовцы, были искусственно сведены в одну группу. Пациенты, имеющие работу, и учащиеся также были сведены в одну группу. К бинарной переменной была сведена переменная инвалидности по психическому заболеванию, т. е. наличие инвалидности кодировалось вне зависимости от группы. Кроме того, бинарными были переменные пола, наследственной отягощенности (наличие психического заболевания у родственников первой линии родства), полюс первого эпизода заболевания (депрессия или мания) и диагноза (БАР I, БАР II, БАР I с психотическими чертами). Дискретными независимыми переменными, включенными в анализ, являлись возраст, возраст манифестации заболевания, продолжительность терапии в исследовании в неделях, суммарный балл по шкале GAF, YMRS, MADRS, а также опроснику качества жизни WHO на момент включения в исследование и на 12-й месяц исследования. В качестве порога статистической значимости использовался р<0,05.
Множественная регрессия применялась для поиска наиболее значимых, независимых факторов, влияющих на положительный эффект профилактической терапии. Поскольку приближенное правило гласит, что нельзя проводить анализ множественной регрессии, если переменных больше, чем число пациентов, деленное на 10, было построено несколько регрессионных моделей. В одних исследовались только демографические показатели, в других же — определенные клинические. Кроме того, поскольку анализ проводился с применением номинальных независимых переменных, имеющих более двух категорий, создавались искусственные бинарные переменные. Каждая модель проверялась с использованием прямого (Forward stepwise) и обратного (Backward stepwise) пошаговых алгоритмов. Для всех моделей á (альфа) принимался за 0,05.
Так, данные всех терапевтических групп использовались для построения двух регрессионных моделей. В первую в качестве независимых переменных были включены демографические (возраст, пол, наличие семьи и работы, наличие группы инвалидности, количество госпитализаций) и наиболее важные клинические признаки (вариант терапии, диагноз, психопатологическая наследственность).
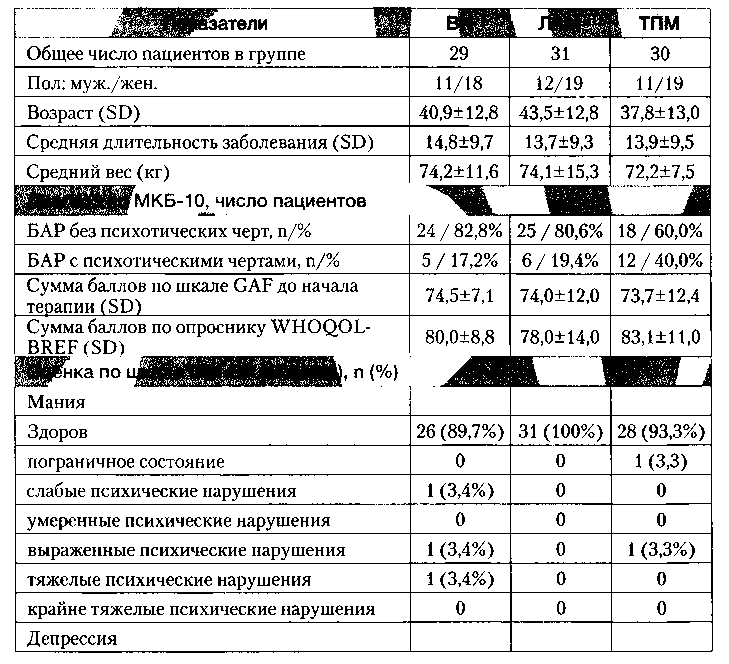
Всего в исследование было включено 90 пациентов (34 мужчины и 56 женщин). Средний возраст больных составил 40,8±12,7 года, средняя длительность заболевания — 14,1±9,4 лет.
Открытым методом больные распределялись в одну из трех терапевтических групп, в которых в течение последующего года применялась монотерапия ВН, ЛАМ или ТПМ.

Статистически значимых различий по основным клинико-демографическим характеристикам между терапевтическими группами не было.
Подробные клинико-демографические характеристики терапевтических групп представлены в таблице 1.