Данное исследование являлось Российской наблюдательной программой по сбору информации о текущем статусе, различных характеристиках и лечении больных шизофренией. Исследование не оказывало влияния на назначение препаратов и не вводило ограничений по видам терапии. Наблюдение проводилось методом «поперечного среза». Оценка больного проводилась в ходе однократного анкетирующего визита с последующим взятием крови натощак, дальнейшего наблюдения не проводилось. В данной программе принимали участие 24 врача-исследователя. Спонсором исследования являлась компания Санофи-Авентис.
В исследование включались больные с любыми формами шизофрении, а также шизофреноформными и шизоаффективными расстройства, в соответствии диагностическими критериями DSM-IV в возрасте 18 лет и старше в стабильном состоянии, получавшие терапию одним и тем же антипсихотическим препаратом в течение не менее 3 месяцев и подписавшие информированное согласие на участие в исследовательской программе.
Пациенты были разделены на две группы в зависимости от основного антипсихотического лечения: «атипичную» и «классическую». В группу «атипичного» лечения включались больные, получавшие атипичный антипсихотик в качестве основной терапии, по крайней мере, в течение 3 месяцев. В группу «классического» лечения включались больные, получавшие в качестве основного антипсихотического лечения традиционный нейролептик в течение, по крайней мере, 3 месяцев. Больные получали лечение в соответствии с назначением лечащего врача. Влияния на назначение препаратов или ограничений по видам терапии не было.
Больные не должны были включаться в исследование, если они соответствовали, хотя бы одному из следующих критериев: у больного имелся острый эпизод шизофрении, у больного имелось острое непсихиатрическое или неотложное состояние, больной участвовал в другом клиническом исследовании.
Из заранее определенного общего количества больных, которое планировалось к включению, 25% больных должны были получать терапию классическими антипсихотическими препаратами, а 75% — атипичными антипсихотическими препаратами. В этой связи в каждом центре рекомендовался набор на каждые 8 включенных больных — 6 больных в группу «атипичной» и 2 больных в группу «классической» терапии.
В ходе единственного визита собирались следующие данные:
- подписанное информированное согласие;
- критерии включения/исключения;
- социально-демографические данные;
- образ жизни больного;
- сопутствующие заболевания и препараты для их лечения;
- факторы риска;
- клинический диагноз;
- анамнез приёма антипсихотических препаратов;
- измеряемые данные;
- биологические показатели крови (гликемия, инсулинемия, Нb1 с, аполипопротеин В, общий холестерин, ЛПВП (липопротеины высокой плотности), триглицериды).
Критериями оценки в данном исследовании являлись:
- Нарушение обмена глюкозы, отклонения в липидных показателях, избыточный вес и абдоминальное ожирение.
- Соотношение рисков между всеми компонентами метаболического расстройства и антипсихотической терапией, а также любыми факторами риска, зарегистрированными в индивидуальной регистрационной карте (ИРК).
Обработка данных осуществлялась по информации, внесённой на бумажную ИРК, за исключением результатов лабораторных анализов, которые передавались электронным образом в центральную контрактно-исследовательскую организацию. Контроль качества данных выполнялся квалифицированным уполномоченным персоналом путем посещения и проверки 5% центров, выбранных случайным образом, либо при выявлении каких-либо особых проблем в дополнительных центрах. Максимальные усилия предпринимались для обеспечения полноты регистрации данных физических измерений и показателей жизнедеятельности, специфического медицинского анамнеза, текущей антипсихотической терапии и даты взятия крови.
Статистический анализ выполнялся с использованием двустороннего тестирования для уровня значимости 5% или с помощью двусторонних доверительных интервалов. Популяционные характеристики включали демографию, аспекты образа жизни, личный анамнез, известные специфические факторы риска и характер антипсихотической терапии. Для количественных переменных описательная статистика включала количество не пропущенных данных, среднее арифметическое, стандартное отклонение, минимум, максимум, медиану и 95% доверительный интервал для средней. Качественные данные описывались частотами значений и процентами, а также 95% доверительным интервалом.
Результаты исследования
В данном исследовании принимали участие 24 врача-исследователя со стажем лечебной практики в среднем 25,7±12,7 лет. Исследовательские центры были расположены в городских клиниках. В исследование был включен 401 пациент с диагнозом шизофрения. Из них 18 (4,5%) пациентов не подлежали оценке из-за отсутствия в картах той или иной информации, и были исключены из последующего анализа.
Распределение больных по группам антипсихотических препаратов соответствовало соотношению, запланированному в протоколе: 25,3% больных (97 пациентов) получали терапию классическими антипсихотиками, 74,7% пациентов (286) лечились атипичными препаратами.
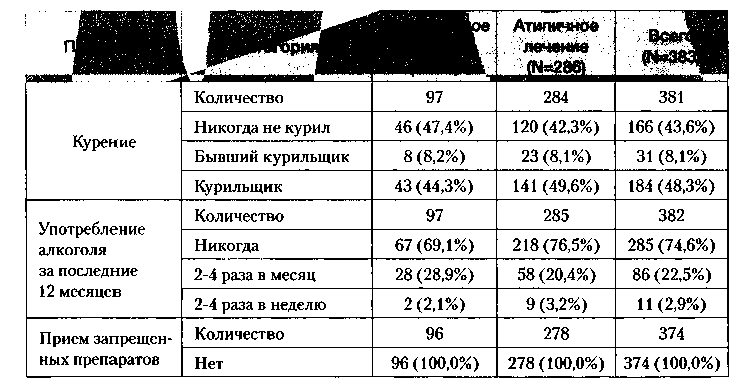
В анализ было включено 40,5% женщин и 59,5% мужчин. Средний возраст больных составил 37,4+12,6 лет в диапазоне от 18 до 73 лет. Возрастная категория «от 18 до 40 лет» составила 59,5% от общей популяции. В семейном положении преобладала категория «холост» (57,2% больных). 90,8% больных проживали дома. 50,9% популяции имели инвалидность, и только 19,9% больных работали полный рабочий день. В изучаемой популяции 43,6% больных никогда не курили, 74,6% больных не употребляли алкоголь в течение последних 12 месяцев, и не было отмечено случаев употребления запрещенных веществ или препаратов. Группы антипсихотического лечения были сходны в распределении больных по данным факторам риска (табл. 1).
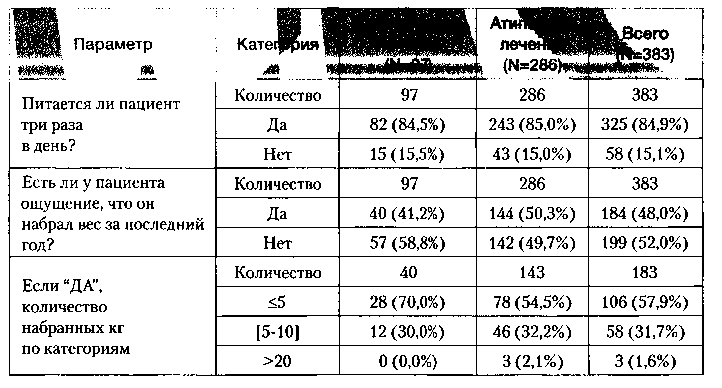
В группе «атипичного» лечения наблюдалась тенденция более несбалансированного пищевого поведения. Наибольшая разница между терапевтическими группами была в таких вопросах, как «Ест ли пациент между основными приемами пищи?» (58,9% против 71,0% соответственно в группах «классического» и «атипичного» антипсихотического лечения), «Ест ли пациент какие-либо сладости несколько раз в день?» (18,6% против 25,9% соответственно в группах «классического» и «атипичного» антипсихотического лечения). На вопрос «Есть ли у пациента ощущение, что он набрал вес за последний год?» утвердительно ответили 41,2% пациентов в группе «классического» лечения и 50,3% пациентов в группе «атипичного» лечения. Соотношение между группами по количеству набранных килограмм за последний год было не в пользу «атипичного» лечения. В группе «классического» лечения 41,2% больных набрали вес, причем из них 70% больных набрали менее 5 кг и 30% больных 5-10 кг. В группе «атипичного» лечения 50,3% больных набрали вес, причем из них 54,5% больных набрали менее 5 кг, 32,2% больных набрали 5-10 кг и 13,3% больных — более 10 кг (табл. 2).
Оценка нарушений пищевого поведения (от 0 до 12 баллов) в среднем составила 4,0+1,9 баллов (95% ДИ от 3,6 до 4,4) и 4,4+2,2 баллов (95% ДИ от 4,1 до 4,6) в группах «классического» и «атипичного» лечения соответственно. В группе «атипичного» лечения балл оказался несколько выше, что свидетельствует о тенденции к нарушению пищевого поведения по сравнению с больными, получающими «классические» препараты, хотя на основании оценки 95% доверительных интервалов различие между группами не являлось статистически достоверным.
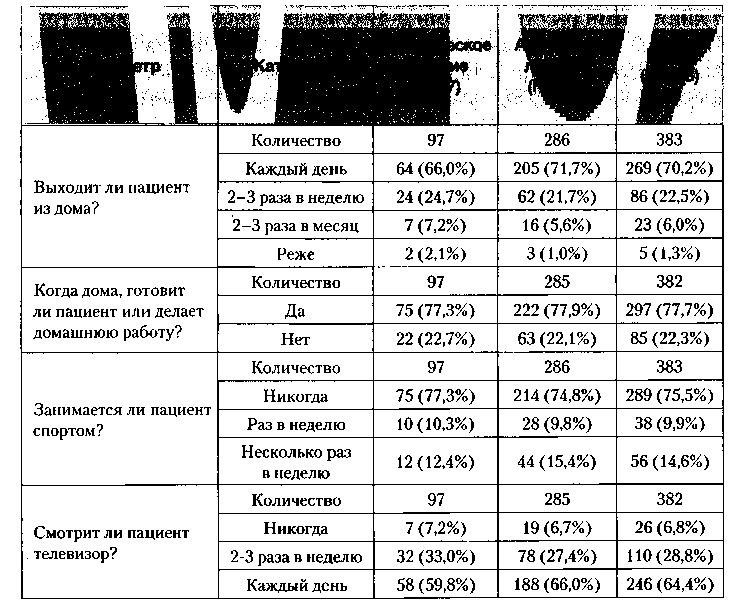
По данным оценки ежедневной активности 75,5% опрошенных больных никогда не занимались спортом, группы лечения значимо не различались по этому показателю: 5,2+1,5 (95% ДИ [4,9;5,5]) в группе «классического» лечения и 5,4+1,4 (95% ДИ [5,3;5,6]) в группе «атипичного» лечения (табл. 3).
Медицинский анамнез пациентов в изучаемой популяции
Группы «классического» и «атипичного» лечения были статистически достоверно схожи по всем характеристикам анамнеза психического заболевания. Так параноидная шизофрения диагностировалась у 77,9% пациентов (74 человека) группы «классического» лечения и у 79,9% (226 человек) «атипичного» лечения, возраст на момент постановки диагноза шизофрении составил 28,3± 10,5 лет в первой группе и 27,6±9,9 лет — во второй. Время прошедшее с момента постановки диагноза составило 155,1124,7 месяцев в первой группе и 111,41108,0 месяцев — во второй. Исключение составила длительность антипсихотического лечения, которая была более продолжительной в группе «классического» лечения» (28,4-+149,2 месяцев против 15,9119,5 месяцев в группе «атипичного» лечения).
По данным медицинского анамнеза других заболеваний (табл. 4), в группе «атипичного» лечения было зарегистрировано 9 больных с липидными расстройствами и 4 больных с диабетом второго типа. В группе «классического» лечения был только один пациент с диабетом первого типа в анамнезе. По данным семейного анамнеза, в группе «атипичного» лечения без достижения статистической значимости было больше больных с семейным анамнезом диабета: 14,0% по сравнению с 8,2% в группе «классического» лечения. Соотношение по семейному анамнезу липидных расстройств в обеих группах было примерно одинаковое. Процент пациентов с артериальной гипертензией у родственников был выше в группе «атипичного» лечения.
Предшествующая и текущая антипсихотическая терапия
На таблице 5 представлена информация о текущей антипсихотической терапии в исследуемой популяции. Предшествующая и текущая терапии были очень схожи по распределению назначавшихся препаратов. В группе «классического» лечения наиболее часто используемым препаратом предшествующей терапии являлся галоперидол, назначавшийся у 39,2% больных. Зуклопентиксол и трифлуоперазин назначались 14,4% и 11,3% пациентов в течение 6 месяцев предшествующей исследованию терапии. В группе «атипичного» лечения пятерку лидеров назначения составили рисперидон (47,9%), оланзапин (15,7%), амисульприд (14,7%), клозапин (13,6%) и кветиапин (9,8%).
Дальнейшее представление результатов наблюдения будет производиться в отдельности для наиболее часто используемых препаратов «классического» и «атипичного» профиля. Все остальные препараты в каждой из групп будут объединены в категорию «Другие препараты».
Метаболические нарушения и антипсихотическая терапия Нарушения обмена глюкозы и липидов
Количество пациентов с нарушениями обмена глюкозы составило 23,2%. Группы достоверно не различались по частоте нарушения гликемии: 25,8% пациентов (95% ДИ [16.5%; 35.1%]) в «классической» и 22,4% пациентов (95% ДИ [16.9%; 27.9%]) в «атипичной». Однако, в группе «атипичного» лечения было больше пациентов с уровнем глюкозы, превышающим 126 мг/дл (табл. 6).
Среди препаратов «атипичного» профиля рейтинг по частоте нарушения гликемии в исследуемой популяции выглядел следующим образом: рисперидон (26,0%), клозапин (20,0%), оланзапин (19,0%), кветиапин (16,0%) и амисульприд (10,3%). Для «классического» препарата галоперидола частота нарушения гликемии составила 28,9%, что превышало показатели «атипичных» препаратов.
Гиперинсулинемия наблюдалась у 24,0% пациентов в исследуемой популяции: у 17,8% пациентов (95% ДИ [10.2%; 25.4%]) в группе «классического» лечения и у 26,1% пациентов (95% ДИ [21.2%; 30.9%]) в группе «атипичного» лечения. Различия между группами и отдельными препаратами не были статистически достоверными. Уровень гликизированного гемоглобина (HbA1c) и параметры липидного обмена (общий холестерин, липопротеиды высокой плотности (ЛПВП), триглицериды, аполипопротеин В) являлись вторичными критериями оценки метаболических нарушений в изучаемой популяции больных шизофренией. Количество пациентов с уровнем HbAlc, превышающим 6%, составило 7,3% в исследуемой популяции больных шизофренией. Группы «классического» и «атипичного» лечения были схожи по уровню HbAlc.
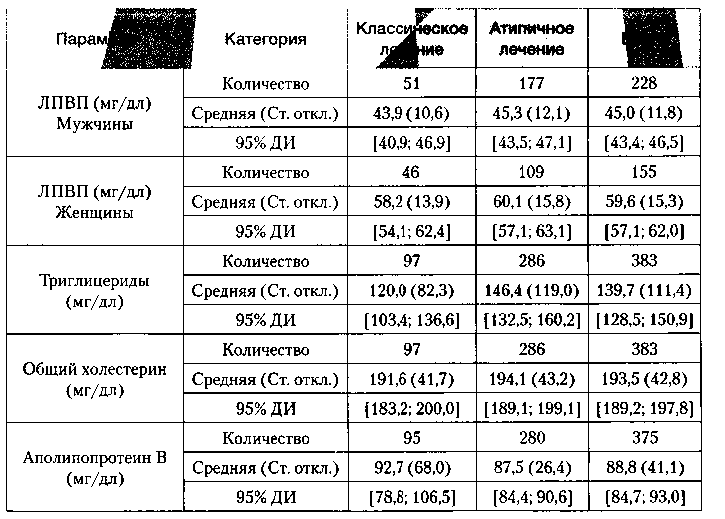
В таблице 7 представлены параметры липидного обмена. В группе «атипичного» лечения наблюдался более высокий уровень триглицеридов по сравнению с группой «классического» лечения. В отношении остальных параметров липидного профиля группы были статистически сопоставимы.
Частота дислипидемии в исследуемой популяции составила 64,1%, что свидетельствует о высоком риске нарушений липидного обмена у больных шизофренией: 62,9% пациентов в группе «классического» лечения и 64,5% пациентов в группе «атипичного» лечения. Различие между группами не было статистически достоверным.
Среди препаратов «атипичного» лечения рейтинг по частоте низкой концентрации ЛПВП (< 40 мг/дл для мужчин и <50 мг/дл для женщин) в исследуемой популяции выглядел следующим образом: клозапин (48,6%), оланзапин (42,9%), амисульприд (33,3%), кветиапин (32,0%) и рисперидон (30,7%). Рейтинг этих препаратов по частоте гипертриглицеридемии (более 150 мг/дл) выглядел следующим образом: клозапин (51,4%), амисульприд (41,0%), оланзапин (38,1%), кветиапин (28,0%) и рисперидон (25,2%).
Увеличение массы тела и метаболический синдром
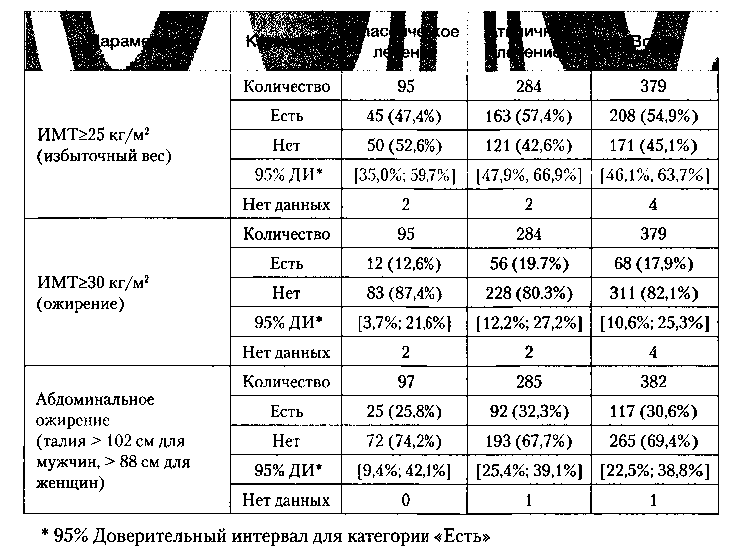
Избыточный вес определялся как индекс массы тела (ИМТ)>25 кг/м2. В исследуемой популяции избыточный вес имели 54,9% пациентов: 47,4% пациентов в группе «классического» лечения и 57,4% пациентов в группе «атипичного» лечения (табл. 8). Ожирение (ИМТ>30 кг/м2) отмечалось у 17,9% пациентов: у 12,6% пациентов в группе «классического» лечения и у 19,7% пациентов в группе «атипичного» лечения. Абдоминальное ожирение (окружность талии у мужчин > 102 см и женщин > 88 см) считается одним из главных факторов развития диабета второго типа. В исследуемой популяции абдоминальное ожирение наблюдалось у 30,6% пациентов: у 25,8% пациентов в группе «классического» лечения и у 32,3% пациентов в группе «атипичного» лечения. По оценке 95% доверительных интервалов, различия между терапевтическими группами не были статистически достоверны.
Рейтинг пациентов с избыточным весом при лечении антипсихотиками выглядел следующим образом: рисперидон (64,6%), оланзапин (56,1%), клозапин (54,3%), кветиапин (54,2%), галоперидол (54,1%), амисульпирид (41.0%) пациентов. Аналогично распределялось и соотношение пациентов с ожирением: оланзапин (24,4%), рисперидон (20,5%), амисульпирид (17,9%), клозапин (17,1%), галоперидол (16,2%), кветиапин (12,5%). По оценке 95% доверительных интервалов, различия между терапевтическими группами не были статистически достоверны.
Среди препаратов «атипичного» лечения рейтинг по частоте набора веса за последний год пациентами в исследуемой популяции выглядел следующим образом: клозапин (62,9%), рисперидон (52,8%), оланзапин (52,4%), амисульприд (41,0%) и кветиапин (36,0%).
В исследуемой популяции гипертензия наблюдалась у 31,2% больных, повышенное систолическое АД (≥ 130 мм рт. ст.) — у 25,2% больных, повышенное диастолическое АД (≥ 85 мм рт. ст.) — у 18,9% больных. Среди них классическое лечение получали 25,3% пациентов и 33,2% — терапию «атипичными» антипсихотиками. Гипотензия отмечалась у 11,5% пациентов первой группы и у 10,2% второй.
Метаболический синдром, в определении Американской диабетической ассоциации, включает в себя такие проявления, как:
- абдоминальное ожирение (окружность талии более 102 см у мужчин и 88 см у женщин);
- гипертриглицеридемия (уровень триглицеридов более 150 мг/дл);
- ЛПВП менее 40 мг/дл у мужчин и менее 50 мг/дл у женщин; гипертензия (АД 130/85 и более мм. рт. ст.);
- содержание глюкозы в крови натощак более 110 мг/дл.
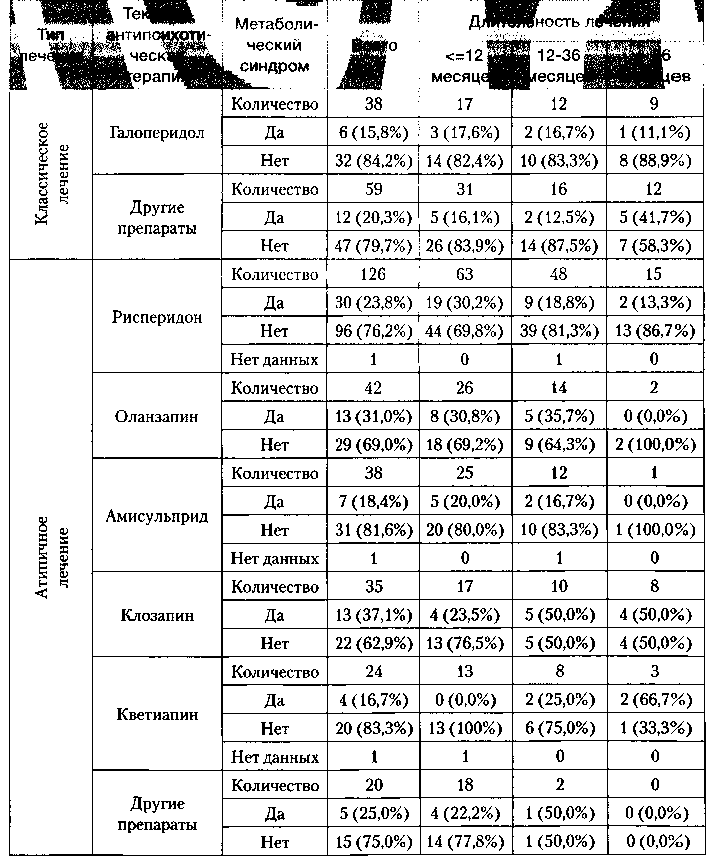
По результатам наблюдения, в группе «атипичного» лечения было больше больных с метаболическим синдромом (25,1%) по сравнению с группой «классического» лечения (19,6%), хотя на основании оценки 95% доверительных интервалов различие между группами не являлось статистически достоверным. Для «классических» препаратов частота метаболического синдрома составила 15,8% пациентов для галоперидола и 20,3% для других препаратов. Среди препаратов «атипичного» лечения рейтинг по частоте метаболического синдрома в исследуемой популяции выглядел следующим образом:
- клозапин (37,1%),
- оланзапин (31,0%),
- рисперидон (23,8%),
- амисульприд (18,4%),
- кветиапин (16,7%).
При длительном применении антипсихотической терапии (>12 мес.) частота развития метаболического синдрома увеличивалась в группах галоперидола и клозапина (табл. 9).
Обсуждение и выводы
Настоящее первое Российское широкомасштабное фармако-эпидемиологическое исследование различных проявлений метаболического синдрома у больных шизофренией показало, что ожирение, нарушение толерантности к глюкозе, гиперлипидемия и гипертензия являются частыми коморбидными соматическими расстройствами и могут осложнять течение и терапию основного заболевания. Однако полученные результаты не позволяют сделать достоверного заключения, являются ли эти нарушения неотъемлемой частью психического заболевания или следствием применения антипсихотической терапии. Частота различных метаболических нарушений, также как и развёрнутый метаболический синдром в целом, были несколько выше у пациентов, получающих лечение атипичными антипсихотическими препаратами по сравнению с галоперидолом и другими традиционными нейролептиками, но эти различия не достигли статистической степени значимости (рис. 1).
Возможно, это связано с разнородностью препаратов в терапевтических группах и другими методическими недостатками настоящего исследования, включая однократную регистрацию всех данных (дизайн «поперечного среза»), отсутствие коррекции влияния на результаты полипрагмазии, предшествующей терапии и её длительности, а также контрольного мониторинга физикальных и лабораторных параметров. В аналогичных рандомизированных западных исследованиях сравнивались преимущественно отдельные атипичные антипсихотики с галоперидолом или плацебо (Beasley С. М. et al., 1996; Tollefson G. D. et al., 1997; Gomez J. C. et al., 2000; Tohen M. et al., 2000). В нашем исследовании частота метаболического синдрома при применении клозапина и оланзапина также была в 2 раза выше, чем при приёме галоперидола, а при применении рисперидона — в 1,5 раза (рис. 2).
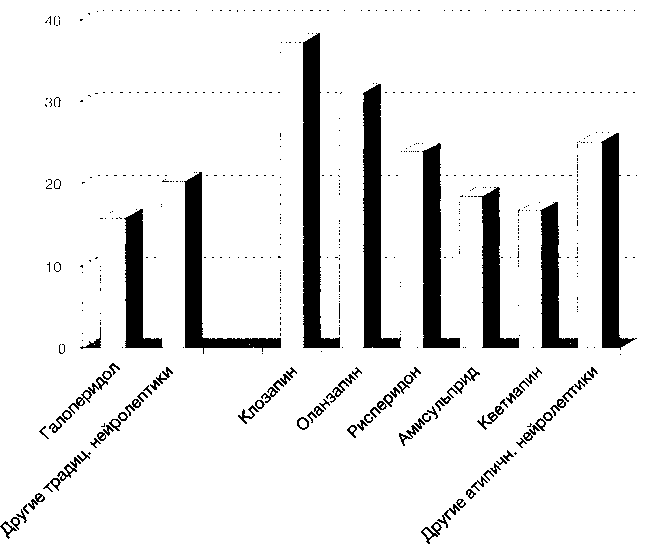
Рис. 2. Частота метаболического синдрома при лечении антипсихотическими препаратами больных шизофренией (%)
В целом результаты анализа Российской популяции больных шизофренией согласуются с опубликованными данными других исследований (Мосолов С. Н. и соавт., 2003,2008; Горобец Л. Н., 2003, 2007), а также данными Американской Диабетической Ассоциации и Американской Психиатрической Ассоциации (2004) относительно риска увеличения веса и развития диабета или дислипидемии, в первую очередь у больных, получающих лечение клозапином и оланзапином. Амисульприд, также как кветиапин и некоторые другие атипичные антипсихотики может быть отнесен ко второй более низкой группе риска.
Больные шизофренией, получающие атипичные антипсихотики, несомненно, должны рассматриваться как группа высокого риска по диабету и сосудистым заболеваниям. Принимая во внимание совокупное влияние избыточного веса и диабета на развитие ишемической болезни сердца (основной причины смертности при шизофрении), усиленное распространением в популяции больных шизофренией курения и малоподвижным образом жизни, предпочтение должно отдаваться антипсихотикам с низким риском развития метаболических нарушений и диабетогенным потенциалом при условии их равной эффективности в отношении основных симптомов шизофрении. Необходимо также введение в практику стандартов мониторирования пациентов, получающих атипичные антипсихотики, с целью выявления метаболических нарушений, включая толерантность к глюкозе, что может снизить у них риск развития сердечно-сосудистых заболеваний. Современные правила ведения больных шизофренией должны также включать в себя профилактику, раннее выявление и адекватное лечение соматических расстройств, эффективную диету и программу физических упражнений. Огромную роль в этом призваны сыграть психообразовательные мероприятия и информирование больных и их родственников.
Литература
- Горобец Л. Н., Ермолаева Л. Г., Жмурина М. В. Проблемы увеличения веса и развития сахарного диабета при нейролептической терапии шизофрении сб. под ред.проф. И. Я. Гуровича и д.м.н. А. Б. Шмуклера «Метаболические побочные эффекты и осложнения при психофармакотерапии» (приложение к журналу «Социальная и клиническая психиатрия»). Москва, 2003, с. 22-28.
- Горобец Л. Н. Нейроэндокринные дисфункции у больных шизофренией и шизоаффек-тивным расстройством в условиях современной антипсихотической терапии (клинико-биохимическое исследование). Автореферат дисс.докт.мед.наук, М. 2007, с. 45.
- Мосолов С. Н., Рыбкиным П. В. Метаболические побочные эффекты современной антипсихотической фармакотерапии//Социальная и клиническая психиатрия, 2008, № 3, с. 75-90.
- Мосолов С. Н., Кабанов С. О. Метаболические нарушения при антипсихотической тера-пии//Социальная и клиническая психиатрия, 2003. т. 13, № 2. с. 162-172.
- American Diabetes Association, American Psychiatric Association, American Association of Clinical Endocrinology, North American Association for the study of obesity. Consensus development conference on antipsychotic drugs and obesity and diabetes//Diabetes Care, 2004, Vol. 27, p. 596-601.
- Beasley C. V.Jr., Sanger X, Satterlee W. et al. Olanzapine versus placebo: results of a doubleblind, fixed-dose olanzapine trial//Psychopharmacology (Berl), 1996, Vol. 124, p. 159-167.
- Bernstein JG Psychotropic drug induced weight gain: mechanisms and management//Clin Neuropharmacol, 1988, Vol. 11 (Suppl 1), S194-S206.
- 8.Casadebaig F, Philippe A, Guillaud-Bataille JM, Gausset MF, Quemada N, Terra JL. Schizophrenic patients: physical health and access to somatic care//Eur Psychiatry, 1997, Vol. 12, p. 289-293.
- Davis JM, Chen N. Old versus new: weighing the evidence between the first- and second-generation antipsychotics//Eur Psychiatry, 2005, Vol. 20, p. 7-14.
- 10.Dixon L, Weiden P, Delahanty J, Goldberg R, Postrado L, Lucksted A, Lehman A. Prevalence and correlates of diabetes in national schizophrenia samples//Schizophr Bull., 2000, Vol. 26, p. 903-912.
- Gomez J. C., Sacristan J. A., Hernandez J. et al. The safety of olanzapine compared with other antipsychotic drugs: results of an observational prospective study in patients with schizophrenia (EFESO study)//J. Clin.Psychiatry, 2000, Vol. 61, p. 335-343.
- Roller E, Doraiswamy PM. Olanzpine-associated diabetes mellitus//Pharmacotherapy, 2002, Vol. 22, p. 841-852.
- Roller EA, Cross JT, Doraiswamy PM, Schneider BS. Risperidone-associated diabetes mellitus: a pharmacovigilance study//Pharmacotherapy, 2003, Vol. 23, p. 735-744.
- Roller EA, Schneider B, Bennett R, Dubitsky G. Clozapine-associated diabetes//Am. J. Med, 2001, Vol. Ill, p. 716-723.
- Roller EA, Weber J, Doraiswamy PM, Schneider BS. A survey of reports of Quetiapine -associated hyperglycemia and diabetes mellitus//J. Clin. Psychiatry., 2004, Vol. 65, p. 857-863.
- Roro CE, Fedder DO, L’ltalien GJ, Weiss SS, Magder LS, Rreyenbuhl J, Revicki DA, Buchanan RW. Assessment of independent effect of Olanzapine and Risperidone on risk of diabetes among patients with schizophrenia: population based nested case-control study//BMJ, 2002, Vol. 325, p. 243-247.
- Rroeze WR, Hufeisen SJ, Popadak BA, Renock SM, Steinberg S, Ernsberger P, Jayathilake K, Meltzer HY, Roth BL. H^histamine receptor affinity predicts short-term weight gain for typical and atypical antipsychotic drugs//Neuropsychopharmacology., 2003, Vol. 28, p. 519-526.
- Lean ME, Pajonk FG. Patients on atypical antipsychotic drugs: another high-risk group for type 2 diabetes//Diabetes Care, 2003, Vol. 26, p. 1597-1605.
- Leucht S, Wagenpfeil S, Hamann J, Rissling W. Amisulpride is an «atypical» antipsychotic associated with low weight gain//Psychopharmacology (Berl)., 2004, Vol. 173, p. 112-115.
- Melkersson R, Dahl ML. Adverse metabolic effects associated with atypical antipsychotics: literature review and clinical implications//Drugs., 2004, Vol. 64, p. 701-723.
- Meyer JM, Кого CE. The effects of antipsychotic therapy on serum lipids: a comprehensive review//Schizophr Res, 2004, Vol. 70, p. 1-17.
- Mukherjee S, Decina P, Bocola V, Saraceni F, Scapicchio PL. Diabetes mellitus in schizophrenic patients//Compr Psychiatry, 1996, Vol. 37, p. 68-73.
- Newcomer JW. Metabolic risk during antipsychotic treatment//Clin Ther, 2004, Vol. 26, p. 1936-1946.
- Sernyak MJ, Leslie DL, Alarcon RD, Losonczy MF, Rosenheck R. Association of diabetes mellitus with use of atypical neuroleptics in the treatment of schizophrenia//Am. J. Psychiatry, 2002, Vol. 159, p. 561-66.
- Tecott LH, Sun LM, Akana SF, Strack AM, Lowenstein DH, Dallman MF, Julius D. (1995) Eating disorder and epilepsy in mice lacking 5-HT2C serotonin receptors. Nature, 1995, Vol. 374, p. 542-546.
- Tohen M., Jacobs T. G., Grundy S. L. et al. Efficacy of olanzapine in acute bipolar mania: a double-blind, placebo-controlled study. The olanzapine HGGW Study Group//Arch.Gen. Psychiatry, 2000, Vol. 57, p. 841-849.
- Tollefson G. D., Beasley C. M.Jr., Tran P. V. et al. Olanzapine versus haloperidol in the treatment of schizophrenia and schizoaffective and schizophreniform disorders: results of an international collaborative trial//Am. J. Psychiatry,1997, Vol. 154, p. 457-465.
- Wetterling T. Bodyweight gain with atypical antipsychotics. A comparative review. Drug Saf; 2001, Vol. 24, p. 59-73.
- Wirshing DA, Wirshing WC, Kysar L, Berisford MA, Goldstein D, Pashdag J, Mintz J, Marder SR. (1999) Novel antipsychotics: comparison of weight gain liabilities//!. Clin. Psychiatry, 1999, Vol. 60, p. 358-363.
- Guidelines for Good Epidemiology Practices for Drug, Device, and Vaccine Research in the United States//Guidelines for Good Epidemiology Practices. March 27, (1996)
- Good epidemiological practice (GEP) proper conduct in epidemiologic research. Draft of 10 May 2002, IE A European Federation.