Общая характеристика гормонов.
Внутрисекреторной частью поджелудочной железы являются островки Лангерганса — скопления клеток, расположенные в экзокринной части железы. Островки имеют размеры около 0,3 мм и составляют около 1,5% объема железы; у человека их насчитывается около 1 млн. Островки Лангерганса состоят из четырех видов клеток. Преобладающими являются β-клетки, составляющие 60—80 % всех островковых клеток и продуцирующие гормон инсулин. Около 20 % островковых клеток представлено α-клетками, вырабатывающими второй панкреатический гормон — глюкагон. В островках находятся также в небольших количествах не содержащие секреторных гранул у- и 5-клетки, вырабатывающие панкреатический гастрин.
Первостепенное значение в физиологических условиях и при патологии имеет инсулин. Значение глюкагона и тем более панкреатического гастрина намного меньше. В последнее время между ацинарными клетками обнаружена еще одна разновидность эндокринных клеток, принадлежащих к так называемой АПУД-системе и вырабатывающих человеческий панкреатический полипептид (пРР).
Инсулин.
Инсулин представляет собой простой полипептид с молекулярной массой около 6000, состоящий из двух линейных цепей: А — с 21 аминокислотой и В — с 30 аминокислотами, соединенных двумя бисульфидными мостиками. В цепи А есть еще один «внешний» бисульфидный мостик. Структура инсулина у различных животных в основном совпадает. В настоящее время принята точка зрения, согласно которой вначале синтезируется одна цепь аминокислот с последующим свертыванием молекулы и образованием бисульфидных связей. В этом процессе участвует так называемый соединительный пептид, или пептид С, состоящий из 33 аминокислот и соединяющий цепи А и В. После свертывания образуется предшественник инсулина, или проинсулин, с молекулярной массой свыше 9000.
Биологическая активность проинсулина составляет примерно 10% активности инсулина. Соединительный пептид С отщепляется от инсулина в гранулах β-клеток перед секрецией в кровь и поступает в нее в количестве, эквимолекулярном инсулину. Определение уровня пептида С является более надежным индикатором секреции β-клеток, чем определение собственно инсулина, так как последний в отличие от С-пептида частично задерживается в печени, может подвергаться воздействию циркулирующих противоинсулиновых антител и подвергаться другим воздействиям, искажающим истинную картину. Разъединение цепей А и В приводит к полной инактивации инсулина.
Эффекты инсулина всегда комплексны и касаются нескольких органов и тканей, оказывая свое действие на различных метаболических и структурных уровнях.
Важнейшим действием инсулина является регуляция утилизации глюкозы в тканях. Особенно ярко этот эффект выражен в печени, мышцах и жировой ткани. Некоторые ткани (головной мозг, половые железы) могут поглощать глюкозу независимо от инсулина. В инсулинзависимых тканях он стимулирует транспорт глюкозы в клетки, ее фосфорилирование, синтез из глюкозы гликогена (гликогено-генез), образование жиров (липогенез) и их депонирование в жировых клетках, тормозит гликогенолиз, косвенно способствует нормальной функции цикла Кребса (через включение ацетил-КоА).
Инсулин оказывает также важное антилиполитическое действие, ингибируя в жировой ткани липазу и препятствуя ее активации другими гормонами (адреналином, глюкагоном). На белковый обмен инсулин оказывает анаболическое действие, способствуя транспорту аминокислот в клетки и, вероятно, стимулируя синтез РНК. Антикатаболическое действие инсулина основано на его способности тормозить гликонеогенез из белков и аминокислот.
В целом инсулин оказывает общеанаболическое действие — нормальный уровень инсулина в жидкостях тела и тканях является условием нормального синтеза протеинов, липидов, углеводов и нуклеиновых кислот в большинстве клеток. Механизмы внутриклеточного действия инсулина комплексные. Согласно современным взглядам существуют по крайней мере четыре механизма реализации внутриклеточных эффектов инсулина:
- активация или торможение клеточных ферментов;
- активация транспорта глюкозы и аминокислот в клетки;
- влияние на синтез РНК и белков;
- ингибирование клеточной аденилатпиклазы и понижение внутриклеточного цАМФ.
Каждый из этих механизмов (а вероятно — и некоторые другие) отражает и объясняет лишь отдельные аспекты действия инсулина.
В целом, действие инсулина можно резюмировать примерно следующим образом: гормон связывается с рецепторами на поверхности клеток-мишеней (прежде всего — печени, мышц и жировых клеток), изменяя характеристики плазматических мембран и облегчая транспорт глюкозы и аминокислот. Одновременно происходит ингибирование аденилатциклазы плазматической мембраны и понижается содержание цАМФ. При этом, вероятно, происходит стимуляция фосфодиэстеразы. Существуют также научные данные в пользу того, что в клетке образуется другой «второй посредник», отличающийся от цАМФ и включающий в клетке анаболические реакции: образование гликогена, белков, жиров и нуклеиновых кислот из низкомолекулярных предшественников, не исключается также непосредственное взаимодействие инсулина с клеточными органеллами, особенно с ядром.
Регуляция секреции инсулина происходит на основе простой обратной связи, регулирующим фактором в которой является уровень гликемии: секреция инсулина повышается при гипергликемии и понижается при гипогликемии. При этом (3-клетки являются одновременно хеморецепторами и эффекторами. К основной регуляции функции (3-клеток присоединяется модулирующее влияние некоторых гормональных факторов: СТГ, гормонов надпочечников — стероидов и катехоламинов. Вероятно, в интраинсулярной регуляции участвуют глюкагон и соматостатин, а также ионы кальция, связанные с кальмодулином. Определенное влияние на секрецию инсулина могут оказывать и нервные факторы (блуждающий нерв). Косвенное участие в регуляции секреции инсулина принимают адреналин, глюкагон, глюкокортиконцы и тиреоидные гормоны, а соответственно, АКТГ и ТТГ, вызывающие гипергликемию. Предполагается, что существуют также интраинсулярные регуляторные связи между α-, β- и γ-клетками, в основе которых лежит непосредственное (не связанное с гипергликемией) стимулирующее действие глюкагона на секрецию инсулина. К другим эндогенным факторам, оказывающим стимулирующее воздействие на секрецию инсулина, относятся некоторые аминокислоты (особенно лейцин и аргинин), ионы натрия, холинергические вещества; высокая внутриклеточная концентрация калия блокирует секрецию инсулина.
Несмотря на наличие многих дополнительных факторов, влияющих на секрецию инсулина, главным регулятором, безусловно, служит глюкоза.
Глюкагон.
Образующийся в α-клетках островков Лангерганса глюкагон представляет собой полипептид, состоящий из 29 аминокислот. В крови он циркулирует в свободной, не связанной с белками форме. Метаболическая деградация глюкагона происходит в основном в печени.
Эффекты глюкагона сравнительно просты и во многом напоминают действие адреналина, являясь как бы зеркальным отображением соответствующих эффектов инсулина. Глюкагон повышает уровень глюкозы в крови, стимулируя гликогенолиз и усиливая процессы гликонеогенеза из аминокислот в печени. Он обладает также выраженным липолитическим действием в жировых клетках. Существенное значение в регуляции гликемии имеет его стимулирующее действие на секрецию инсулина: косвенная стимуляция через гипергликемию и быстрая прямая стимуляция. Фиксируясь на специфических рецепторах плазматической мембраны клеток-мишеней, в основном печени, глюкагон активирует аденилатциклазу, приводит к усилению распада гликогена, а также участвует в регуляции синтеза ферментов печени. Липолитическое действие глюкагона также опосредовано аденилатциклазной системой и по механизмам подобно другим липолитическим факторам, особенно адреналину и АКТГ.
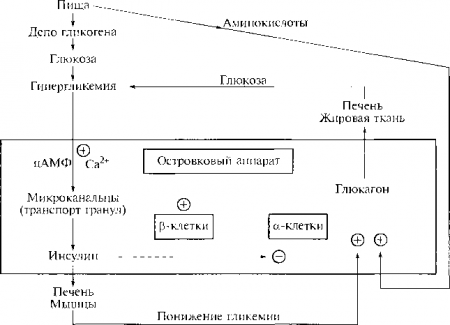
Главным регулирующим фактором секреции глюкагона является уровень глюкозы в крови с противоположным по отношению к инсулину знаком. Секреция глюкагона стимулируется также повышением уровня аминокислот. Высокая секреция инсулина, как было указано выше, на основе местных регуляторных механизмов (в пределах островков) подавляет секрецию глюкагона. Упрощенная схема регуляции секреции инсулина и глюкагона и связей между ними приведена на рис. 15.3.
Рис. 15.3. Схема взаимоотношений инсулина и глюкагона в регуляции гликемии:  — стимуляция;
— стимуляция; — торможение
— торможение
Нарушения эндокринных функций поджелудочной железы.
Гипоинсулинизм.
Дефицит инсулина или нарушения реализации его эффектов в клетках (гипоинсулинизм) является основой одного из самых частых эндокринных расстройств — сахарного диабета, заболеваемость которым имеет отчетливую тенденцию к возрастанию.
Этиология сахарного диабета (устар. — сахарное мочеизнурение, diabetes mellitus, от лат. diabetes — проникать сквозь) был в основных своих внешних проявлениях описан в глубокой древности. Укоренившееся название связано с тем, что первоначально сущность заболевания сводили к двум его характерным проявлениям: выделению значительно повышенных количеств мочи и постоянному присутствию в ней сладких веществ. Постепенно симптоматика диабета становилась все более расширенной, однако никаких реальных данных о причинах болезни и механизмах ее развития в течение многих веков не было. Безуспешными были, как правило, и попытки лечения диабета. Лишь в самом конце XVIII в. впервые встречается упоминание о повреждении при диабете поджелудочной железы и лишь спустя еще 100 лет удалось получить экспериментальную модель сахарного диабета полным удалением у собак поджелудочной железы. Вскоре было установлено, что поджелудочная железа является не только внешне-, но и внутрисекреторной, и что ее эндокринная функция осуществляется ранее обнаруженными островками Лангерганса. В начале XX в. из них был извлечен инсулин, вскоре получен в кристаллическом виде и в большинстве случаев вполне успешно использован для лечения больных, страдающих диабетом.
Сахарный диабет может быть вызван первичной абсолютной инсулиновой недостаточностью, т.е. нарушением синтеза и секреции гормона (3-клетками. Причинными факторами, повреждающими и даже разрушающими (3-клетки, являются хронический панкреатит (20 — 40% больных страдают диабетом), опухоли поджелудочной железы (признаки диабета выявляются у 8—10% больных), гемохроматоз (30 — 80 % больных, наследственное заболевание, характеризующееся повышенным всасыванием в кишечнике железа и его накоплением в различных тканях, в том числе и в поджелудочной железе).
Повреждение железы (включая островковый аппарат) может быть вызвано ее кальцификацией, склерозом сосудов, инфекционными процессами, кистами и др. Своеобразная форма нарушения способности β-клеток адекватно отвечать на стимулирующее действие глюкозы наблюдается при длительной гипергликемии, приводящей к снижению чувствительности мембранных рецепторов к глюкозе и даже к уменьшению их числа.
Важное значение придают аутоиммунным механизмам повреждения (3-клеток. Причиной первичной альтерации этих клеток являются вирусные и другие инфекционные заболевания, возможно — некоторые токсические воздействия. Исходя из общих закономерностей развития аутоиммунных процессов, можно предположить, что почти любой из упомянутых выше повреждающих факторов приводит к изменению антигенных свойств (3-клеток и включению механизма выработки аутоантител против различных клеточных структур, в том числе и рецепторов. Возможно также, что в основе аутоиммунного повреждения (3-клеток в некоторых случаях лежат первичные изменения в иммунной системе.
Несомненное значение имеют наследственные факторы в возникновении сахарного диабета. К этим факторам относятся различные варианты генетически обусловленных нарушений — уменьшение биосинтеза инсулина, биосинтез инсулина ненормального строения, с иммунологически идентичными нормальному гормону свойствами, но утратой значительной части специфической активности, нарушения в системе аденилатциклазы и др.
Сахарный диабет может развиться и в тех случаях, когда β-клетки выделяют нормальное количество полноценного инсулина, но до клеток-мишеней он доходит в дефиците. Считается, что такое явление связано с чрезмерной задержкой и инактивацией инсулина в печени, образованием некоторых белковых ингибиторов, избыточной продукцией «контринсулярных» гормонов и выработкой аутоантител к иммунологически отличающемуся от нормального и даже к нормальному инсулину, уменьшением свободной (активной) фракции инсулина в результате слишком прочной его связи с белками крови, утолщением базальной мембраны капилляров, препятствующим выходу инсулина в межклеточное пространство и др.
Подобного рода состояния относятся к внепанкреатическим (небета-клеточным) формам сахарного диабета. В основе некоторых из них лежит абсолютная, других — относительная инсулиновая недостаточность (хотя интерпретация содержания этих терминов бывает иногда затруднительной).
Третий вариант сахарного диабета имеет явно периферический генез и обусловлен снижением чувствительности тканей (клеток-мишеней) к инсулину. При этом в крови имеется достаточное количество или даже избыток инсулина, (3-клетки часто гипертрофированы, однако имеются бесспорные признаки диабета.
Данный вариант сахарного диабета представляет собой разнородную группу заболеваний, в которых инсулино-резистентность вызвана различными рецепторными и пострецепторными нарушениями. Нарушения могут быть количественными и качественными. Различают четыре группы собственно рецепторных нарушений.
Количественные нарушения рецепторов инсулина включают следующие группы:
- усиленная деградация;
- нарушение биосинтеза рецептора.
Качественные нарушения рецепторов инсулина подразделяют на две группы:
- нарушение фосфорилирования рецептора:
- ненормальная связь рецептора с гормоном.
Кроме того, выявляются пострецепторные формы, когда все процессы, вплоть до связи инсулина с рецепторами клеток-мишеней, происходят нормально, но в каком-либо из внутриклеточных звеньев реализации гормонального эффекта (начиная с ингибирования аденилатииклазы и понижения содержания цАМФ) возникают нарушения. Среди причин периферических рецепторных и пострецепторных форм диабета часто играет роль хроническое переедание, приводящее к избыточной стимуляции (3-клеток и гиперинсулинизму, длительное воздействие которого приводит к снижению чувствительности тканей к инсулину в результате убыли инсулиновых рецепторов.
Существенную роль могут играть и генетические дефекты, приводящие к метаболическим нарушениям, прямо или косвенно влияющим на периферические рецепторные и пострецепторные процессы.
Установлена также возможность участия антирецепторных антител в деградации инсулиновых рецепторов.
Предложено немало классификаций диабета, в основу которых легли различные критерии: степень и внешние проявления нарушений, стадии развития заболевания, возраст больного, наличие жировых отложений и др.
В настоящее время принято выделять два основных типа сахарного диабета: тип 1 и тип 2.
Тип 1 называют также инсулинзависимым. Такой тип диабета возникает в результате недостаточной секреции инсулина (3-клетками. Уровень инсулина в крови у таких больных после нагрузки глюкозой не повышается или увеличивается лишь незначительно. Тяжелая форма сахарного диабета 1-го типа поражает молодых людей (ювенильный диабет) и значительно реже нетучных взрослых.
Сахарный диабет 1-го типа в настоящее время рассматривается как аутоиммунное заболевание. Он иногда встречается в комбинации с другими аутоиммунными эндокринными расстройствами (гипертиреоз, тиреоидит и др.). Определяющую роль играют генетические факторы.
Диабет 2-го типа называют инсулиннезависимым. В крови у таких больных содержится нормальное или повышенное количество инсулина, сохраняется реакция на гипергликемию. Данный тип диабета обусловлен нечувствительностью клеток к инсулину и является периферической формой гипоинсулинизма, описанной выше.
Патогенез сахарного диабета многообразен. Сахарный диабет характеризуется многочисленными и разнообразными метаболическими, структурными и функциональными нарушениями. Часть из них является непосредственным следствием выпадения или ослабления специфических эффектов инсулина, другая часть возникает вторично как результат свойственных диабету метаболических расстройств.
Кардинальным признаком всех трех форм диабета является гипергликемия. Вместо нормальных 0,8—1,2 г/л содержание глюкозы в крови может возрасти до 4—5 г/л, иногда до 10 г/л.
Главной причиной гипергликемии является уменьшение утилизации глюкозы в тканях, ее транспорта в клетки, фосфорилирования, превращения в гликоген и депонирования в печени и мышцах, превращения в жир, включения в цикл трикарбоновых кислот и пентозомонофосфатный шунт. Вторым важным источником гипергликемии служит глюкоза, образующаяся из белков в процессе гликонеогенеза, растормаживающегося при дефиците инсулина. Еще одной причиной гипергликемии служит усиление гликогенолиза.
Второй важный признак сахарного диабета — глюкозурия. В моче здоровых людей глюкоза не содержится и может появляться на короткое время лишь после приема больших количеств быстро всасывающихся из кишечника углеводов при интенсивной физической нагрузке, сильном психоэмоциональном напряжении и некоторых других преходящих состояниях организма, сопровождающихся гипергликемией. Полная реабсорбиия глюкозы в почечных канальцах происходит, если ее уровень в крови не превышает 1,7 —1,8 г/л; при более высоком содержании возникает глюкозурия. Следовательно, канальцы почек больных диабетом ежедневно реабсорбируют значительно большие количества глюкозы по сравнению с нормой. Длительная реабсорбция чрезмерного количества глюкозы ведет к истощению их ферментной активности. В результате реабсорбция глюкозы может ослабляться, и при неизменном уровне гипергликемии глюкозурия может нарастать.
Третий кардинальный признак диабета — полиурия. В норме суточный диурез составляет 1500—2000 мл, при диабете он возрастает до 3 000 — 10000 мл и выше. Полиурия при диабете носит осмотический характер. Основной ее причиной служит гипергликемия. У больного диабетом на I г выделяемой глюкозы приходится от 15 до 40 мл мочи. Осмотической полиурии способствует также выделение почками содержащихся при диабете в избытке продуктов белкового обмена, кетоновых тел, натрия и др.
Четвертый признак — гиперкетонемия. В норме в крови содержится 0,02— 0,10 г/л кетоновых тел (ацетоуксус-ной, (3-гидроксимасляной кислот и ацетона). При диабете их содержание может повышаться до 0,3 —0,4 г/л, а в особо тяжелых случаях — до 2 г/л. Концентрация кетоновых тел в крови зависит от их поступления из печени и утилизации тканями. При диабете резко повышается липолиз и поступление свободных жирных кислот в печень, где они усиленно окисляются. В процессе их окисления образуется большое количество ацетил-КоА, который в нормальных условиях через несколько этапов мог бы снова превратиться в жирные кислоты или подвергнуться окислению в цикле лимонной кислоты. Однако при дефиците инсулина резко ослабляются липогенез и окисление ацетил-КоА, который накапливается в печени в больших количествах и превращается в кетоновые тела.
В нормальных условиях с мочой выделяются следовые количества кетоновых тел, при диабете за сутки их может выделиться несколько десятков граммов. Высокая кетонурия является признаком резкого увеличения тяжести заболевания.
Гиперазотемия,
Гиперазотемия, достигающая 0,5 — 0,6 г/л и более, является следствием усиленного катаболизма белков, интенсивного дезаминирования аминокислот в печени в процессе гликонеогенеза, образования больших количеств аммиака, мочевины и других азотистых соединений и поступления их в кровь. Увеличивается и выделение продуктов распада белков с мочой.
В крови здоровых людей общее содержание липидов составляет 15,6 — 26,0 ммоль/л. При диабете оно повышается до 130—260 ммоль/л и более. Причинами гиперлипидемии являются усиление липолиза, синтеза холестерина в печени из кетоновых тел, затруднение утилизации жиров на периферии. Дефицит инсулина приводит, в частности, к недостаточному синтезу фермента липопротеидлипазы, необходимой для нормального метаболизма жиров, входящих в липопротеиновые комплексы. β-Липопротеиды и другие липопротеиды не расщепляются, циркулируют в крови, а затем откладываются в сосудистых стенках. При диабете затруднен также переход неэтерифицированных жирных кислот в мышцы и другие ткани.
Гиперлактацидемия.
Содержание молочной кислоты в крови здоровых людей составляет 0,08 — 0,13 г/л. При сахарном диабете оно возрастает в 1,5—2 раза за счет усиленного поступления молочной кислоты в кровь из различных органов и тканей, что связано с нарушением ресинтеза гликогена из лактата и затрудненным метаболизмом в цикле трикарбоновых кислот. Наряду с гиперкетонемией повышенное содержание молочной кислоты способствует развитию ацидоза.
Полидипсия, или увеличенная жажда, при диабете обусловлена обезвоживанием организма вследствие полиурии, гиперосмии крови, а также сухостью слизистой оболочки полости рта и глотки из-за недостаточности слюноотделения.
Среди многочисленных осложнений сахарного диабета наибольшее значение имеют диабетические макро- и микроангиопатии, нейропатии, нефропатии, нарушение зрения. В основе этих нарушений лежат многообразные расстройства углеводного, липидного, белкового и других видов обмена.
Так, избыток глюкозы в крови может привести к увеличению содержания углеводного компонента в гликопротеидах и изменению их структуры, что приводит к утолщению базальных мембран сосудов и играет решающую роль в развитии диабетических микроангиопатий. Нарушение нормальных путей метаболизма глюкозы может привести к ее превращению в сахаро-спирт — сорбит. Последний, накапливаясь в тканях хрусталика и нервных клетках, способствует развитию катаракты и диабетических нейропатий.
Избыток глюкозы может вызвать гликозилирование белков — неэнзиматическую связь с углеводами, приводящую к нарушению их свойств (например, гликозилирование гемоглобина). Нарушение белково-липидного обмена способствует развитию макроангиопатий и атеросклерозу сосудов.
Наиболее грозным осложнением сахарного диабета являются две разновидности диабетической комы — кетонемическая и гиперосмолярная.
Гиперинсулинизм.
Эта форма нарушений эндокринной функции поджелудочной железы встречается редко. Причиной выраженного гиперинсулинизма являются аденомы и карциномы β-клеток, вырабатывающие избыток инсулина. Эти опухоли не подчиняются механизмам обратной связи и выделяют инсулин независимо от уровня гликемии; часто они выделяют также проинсулин.
Основным проявлением гиперинсулинизма является синдром острой гипогликемии, который может привести к крайне тяжелому состоянию — гипогликемической коме.
Стоматологические проявления сахарного диабета.
Одним из ранних признаков сахарного диабета являются сухость во рту, потеря нитевидных сосочков языка и жжение слизистой оболочки, повышенная жажда и аппетит. У 10% больных сахарным диабетом наблюдается увеличение околоушных слюнных желез.
Изменения в пародонте являются ранним симптомом сахарного диабета. У 80—90% больных воспалительнодистрофические изменения в пародонте обнаруживаются даже при самой легкой форме заболевания.
Между давностью и тяжестью заболевания сахарным диабетом и состоянием тканей пародонта существует зависимость.
Рентгенологически при сахарном диабете выявляется диффузный остеопороз и атрофия альвеолярной кости различной степени выраженности. Повышена вирулентность микрофлоры в полости рта с преобладанием гингивопатогенных видов, особенно при тяжелой форме заболевания. Воспалительные процессы в пародонте сочетаются с активным отложением зубного камня.
В механизме развития патологических процессов в пародонте большое значение имеет уменьшение резистентности капилляров десны, при этом интенсивность изменений постепенно прогрессирует с развитием заболевания. В патогенезе заболеваний пародонта при сахарном диабете ведущее место принадлежит ангиопатии сосудов в основном микроциркуляторного русла. Изменения сосудов заключаются в утолщении стенки и базальной мембраны, что сопровождается снижением сосудистой проницаемости.
Гистохимические исследования слизистой оболочки межзубных сосочков у больных сахарным диабетом отражают нарушения углеводного и белкового обмена веществ аналогично нарушению обмена веществ в других органах и тканях организма.
Воспалительные процессы в пародонте обостряются, особенно в стадии декомпенсации сахарного диабета.
У 95 % больных, особенно в пожилом возрасте, развивается ксеростомия, при этом слизистая оболочка вследствие понижения влажности становится матовой и восковой, язык часто гладкий с выраженной атрофией сосочков.
Невралгия тройничного нерва может быть одним из признаков сахарного диабета.
Течение и лечение хирургической инфекции (флегмоны, фурункулеза и др.) у больных диабетом отличается быстрым распространением патологического процесса, прогрессированием тканевых повреждений и сильными болевыми ощущениями. Инфекционные процессы в околозубных тканях ухудшают течение самого диабета и могут способствовать развитию коматозного состояния.
Симптомы интоксикации наблюдаются очень рано, когда местные проявления воспалительного процесса выражены еще слабо. Определяется отчетливая связь между уровнем сахара крови и течением воспалительного процесса.
Диабет является фактором, предрасполагающим к развитию различного рода осложнений после удаления зуба и других поликлинических вмешательств. Заживление лунки происходит значительно медленнее и сопровождается осложнениями.
Дети, больные сахарным диабетом, обычно жалуются на жажду, сухость во рту, жжение слизистой оболочки полости рта. Часто отмечается извращение вкуса на соленое и кислое, что объясняется снижением секреторной функции слюнных желез, нарушением кислотно-основного равновесия в полости рта и микробиоценоза.
Слизистая оболочка полости рта легко повреждается и ее регенераторные способности снижены. Интенсивность поражения кариесом постоянных зубов у больных детей выражена не более, чем у здоровых.
Клинические проявления сахарного диабета в полости рта детей усиливаются с тяжестью нарушения обменных процессов в организме.