Распределение больных в терапевтических группах по основному показателю эффективности терапии (3-балльной врачебной шкале глобальной профилактической эффективности) отражено в таблице 2.
Проведенный анализ показал, что в целом эффективность профилактической терапии рецидивов депрессии исследуемыми АД оказалась достаточно высокой. Так, у 49,5% пациентов из общего числа не наблюдалось рецидивов депрессии, еще 25% были оценены как ЧР. Таким образом, положительный эффект терапии имел место у 74,5% пациентов
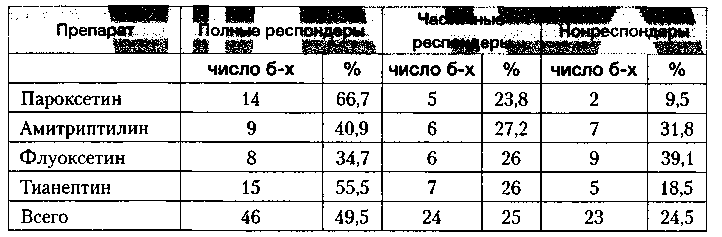
Таблица 2. Оценка профилактического действия ПАР, АМИ, ФЛУ и ТИА по 3-балльной врачебной шкале глобальной профилактической эффективности
В ходе исследования выяснились значительные различия между группами АД по эффективности профилактической терапии. Общее число респондеров, т.е. больных с положительным эффектом терапии в группе ПАР, составило 19 (90,5%), что статистически достоверно (х2 = 5,31, р<0,02) превосходило общее число респондеров в группе АМИ — 15 больных (68,1%). В группе ТИА общее число респондеров, т. е. больных с положительным эффектом терапии, составило 22 (81,1%), что также статистически достоверно превосходило (р<0,04) число респондеров в группе АМИ. Статистических различий по показателю общей эффективности между группами ФЛУ и АМИ не было выявлено.
Большая часть пациентов в группах ПАР и ТИА, относилась к ПР (66,7% и 55,6%, соответственно), в то время как в группах, где пациенты принимали ФЛУ и АМИ, распределение по эффективности произошло приблизительно в равных пропорциях. ПР в этих группах оказались 34,7% и 40,9% больных, соответственно. При этом соотношение ЧР во всех группах оказалось приблизительно равным (23,8% — ПАР, 27,2% — АМИ, 26% — ФЛУ, 25% — ТИА).
Существенные различия между препаратами наблюдались и по числу HP. Так, в группах ПАР и ТИА (9,5% и 18,5%) число HP было существенно ниже, чем в группах ФЛУ и АМИ (39,1% и 31,8%).
В то же время статистически достоверных различий между группами по числу ПР, ЧР и HP не установлено, по-видимому, в силу малой статистической мощности исследования.
Сокращение частоты рецидивирования является одним из наиболее важных показателей профилактической эффективности терапии, так как именно частые рецидивы приводят больных РДР к утрате трудоспособности и социальной дезадаптации. В связи с этим в настоящем исследовании представлялось важным проанализировать динамику частоты рецидивирования в процессе профилактической терапии исследуемыми АД.

Таблица 3. Среднее число депрессивных эпизодов в контрольном и лечебном периодах в группах ПАР, ТИА, ФЛУ, AMИ
Наибольшая редукция этого показателя имела место в процессе терапии ПАР (на 82,3%), наименьшая — в группе ФЛУ (на 68,5%). В группе ТИА уменьшение частоты рецидивов составило 79,1%, в группе АМИ — 72,5%. Статистический анализ показывает высокую достоверность (р<0,01) редукции частоты депрессивных эпизодов в контрольном периоде, как по всей группе, так и в каждой терапевтической группе в отдельности. Между группами статистически достоверных различий по показателю редукции частоты депрессивных эпизодов установлено не было. В тоже время наименьшая выраженность редукции числа депрессивных эпизодов наблюдалась в группах пациентов, принимавших АМИ и ФЛУ, однако эти различия незначительны.
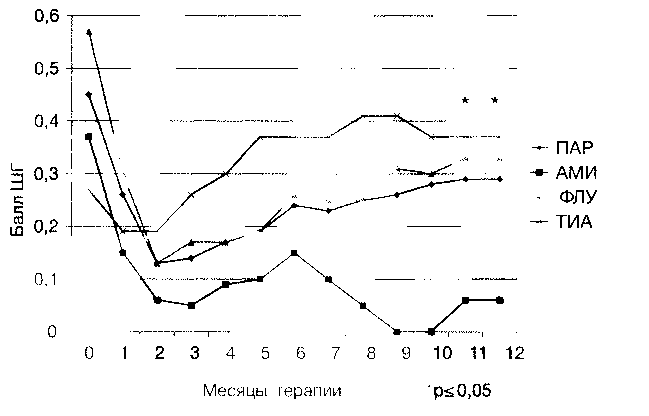
В настоящем исследовании для оценки качества достигнутой ремиссии и выраженности развивающейся в процессе терапии депрессивной симптоматики использовалась ШГ. Данные о динамике суммарного балла ШГ приведены на рисунке 1.
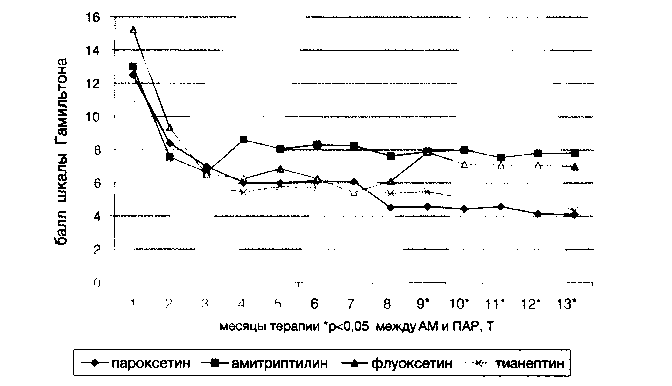
Рис 1. Динамика суммарного балла шкалы Гамильтона за год профилактической терапии при терапии АД нового поколения (ПАР, ТИА, ФЛУ) и АМИ
Из графика видно, что через 2-3 месяца терапии во всех группах значение показателя суммарного балла ШГ снизилось относительно исходного уровня и соответствовало уровню качественной ремиссии (менее 7 баллов), а различия между группами отсутствовали.
С 3 месяца терапии динамика этого показателя в исследуемых группах существенно различалась. В группе АМИ в этот период значение суммарного балла ШГ увеличилось (ближе к 8 баллам), что отражает снижение качества ремиссии, и на всем протяжении дальнейшего лечения оно существенно не менялось. Клинически в этот период времени у нескольких пациентов наблюдались рецидивы депрессии, а у большинства других улучшение качества ремиссии, имевшее место в первые 3 месяца терапии, прекратилось. Ремиссия в группе АМИ часто характеризовалась колебаниями настроения субдепрессивного характера. Больные жаловались на неполное восстановление работоспособности, говорили, что не справляются с профессиональной или домашней деятельностью в полном объеме, испытывают дневную сонливость и идеаторную заторможенность.
В группе ПАР, напротив, редукция показателя суммарного балла ШГ оставалась поступательной на всем протяжении терапии. Исключение составляет лишь период 5-6 и 9-10 месяцев лечения, когда среднее по группе значение этого показателя несколько увеличивалось. Клинически у большинства больных, принимавших ПАР, ремиссия была более чистой, характеризовалась эутимным настроением, нормальной работоспособностью и социальной активностью. Динамика становления и удержания ремиссии у пациентов, принимающих ТИА, практически полностью совпадала с группой ПАР.
В группе ФЛУ качество ремиссии сохранялось на высоком уровне (6-7 баллов) до 9 месяца терапии, после чего несколько снизилось (7-8 баллов), не достигая, впрочем, уровня группы АМИ.
Наилучшее качество ремиссии в среднем за год профилактической терапии было у пациентов, принимавших ТИА (5,45±0,93 баллов), наихудшее — у пациентов, принимавших АМИ (9,5±1,38 балла).
Несмотря на различия качества ремиссии в группах и различия в динамике ее становления до 4-го месяца статистически достоверных различий не отмечалось. Лишь на 4-м месяце терапии в связи с несколькими рецидивами и прекращением дальнейшего улучшения качества ремиссии в группе пациентов, принимавших АМИ, показатели в этой группе значительно ухудшились по сравнению с тремя другими группами. Особенно выраженные различия (р<0,05) наблюдались между группами АМИ и ТИА. Различия между группами АМИ и ПАР также были значительны, но не достигали статистической достоверности (р=0,69).
Значительные различия между группами АМИ, с одной стороны, и группами ПАР, ТИА, ФЛУ, с другой, сохранялись и на 5-й, 6-й, 7-й, 8-й месяцы терапии, но не достигали статистической достоверности. На 9-й месяц терапии качество ремиссии в группе пациентов, принимавших ФЛУ, существенно ухудшилось (9,13±1,83 балла), однако снижение качества ремиссии в группе ФЛУ до конца лечебного периода не было статистически достоверным по сравнению с группами ТИА и ПАР. Некоторое ухудшение качества ремиссии в группе АМИ к 9 месяцу, а также постепенное улучшение качества ремиссии в группах пациентов, принимавших АД нового поколения, привело к статистически значимым различиям между этой группой и группами ТИА и ПАР. В дальнейшем между этими группами сохранялись достоверные различия до конца профилактической терапии (р<0,05). Исключение составил 11-й месяц терапии, когда между группой ПАР и AMИ различия были существенными, но не достигли достоверных значений.
Из рис. 1 видно, что до 3-го месяца включительно в каждой группе наблюдалась положительная сходная динамика. Это подтверждается тем, что показатели всех групп колеблются в узком коридоре 5,8-7,0 баллов, и между показателями нет статистических различий. Начиная с 3-го месяца терапии и до окончания исследования, наблюдался больший разброс показателей качества терапевтической ремиссии от 4 до 9 баллов. Однако существует четкая корреляция между качеством ремиссии и частотой рецидивов для пациентов, принимавших профилактическую терапию АД нового поколения. Так, между низким качеством ремиссии (более 7 баллов по ШГ) в группах АМИ и ФЛУ существовала корреляция с большей частотой рецидивов.
Также существует выраженная корреляция между качеством ремиссии и частотой выбытия из исследования в связи с рецидивом. Так, у пациентов, принимавших АМИ или ФЛУ, низкое качество ремиссии (по суммарному баллу ШГ) соответствовало частому выбыванию вследствие рецидива. У пациентов, принимавших ПАР или ТИА, высокое качество ремиссии соответствовало низкому выбыванию пациентов из исследования в связи с рецидивом.
Косвенными, но весьма важными при длительной терапии показателями качества ремиссии являются качество жизни и уровень социального функционирования. В настоящем исследовании они оценивались пациентами по шкале качества жизни ВОЗ и исследователем по шкале социального функционирования (SOFAS) (DSM — IV, 2000).
Улучшение показателей шкалы SOFAS наблюдалось во всех группах, однако в группе пациентов, принимавших АМИ, улучшение качества жизни продолжалось до 3-го месяца терапии и в дальнейшем существенно не менялось, сохраняясь на одном уровне. Для большинства пациентов эта динамика заключалась в повышении способности справляться с домашними делами, некоторые пациенты отмечали улучшение профессиональных возможностей. Как видно из рисунка 2, во всех группах показатели социального функционирования уже со 2-го месяца терапии до окончания исследования статистически достоверно улучшались по сравнению с исходным
уровнем (р<0,05). При этом уже на первом месяце терапии уровень социального функционирования был статистически выше в группе ПАР и ТИА по сравнению с группой АМИ (р<0,05). С 3-го месяца терапии уровень социального функционирования в группах ПАР, ТИА, ФЛУ был выше, чем в группе АМИ. В дальнейшем, эта динамика показателей шкалы SOFAS по группам сохранялась и к 6-му месяцу терапии различия между группами ПАР, ТИА с одной стороны, и группой АМИ с другой, оказались достоверными (р<0,001).
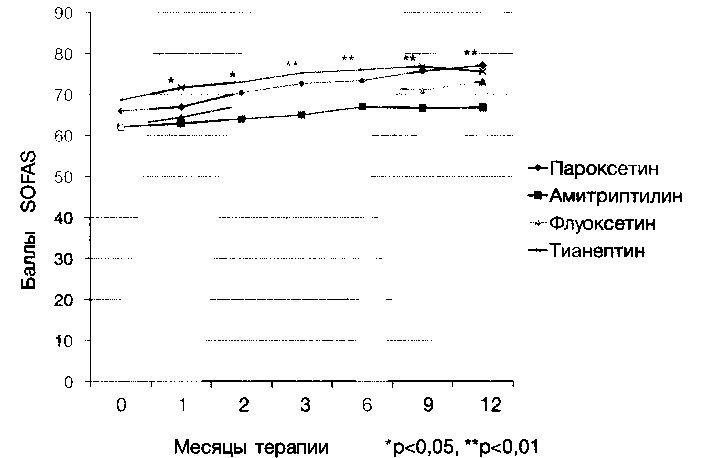
Рис. 2. Сравнительная динамика качества жизни больных по шкале SOFAS за 12 месяцев профилактической терапии ПАР, ТИА, ФЛУ, АМИ
При оценке качества жизни по шкале ВОЗ наблюдалась сходная динамика. Улучшение показателей качества жизни было значимым во всех группах, однако, в группе ПАР оно было наиболее выраженным и к 9-му месяцу достигло статистического уровня значимости (р<0,05).
Как видно из рисунка 3, во всех группах отмечалось улучшение качества жизни, начиная с 1-го месяца терапии. Уже на 2-й месяц терапии показатели шкалы ВОЗ были статистически достоверно выше в сравнении с исходным уровнем. Положительная динамика наблюдалась во всех группах до 6-го месяца терапии. В дальнейшем улучшение качества жизни в группе АМИ отсутствовало, в то время как в группах пациентов, принимающих АД нового поколения, повышение качества жизни продолжалось до окончания исследования. К 9-му месяцу терапии различия между группой АМИ и группами АД нового поколения достигли достоверных статистических величин (р<0,05). К окончанию исследования различия стали еще более выраженными (р<0,01).
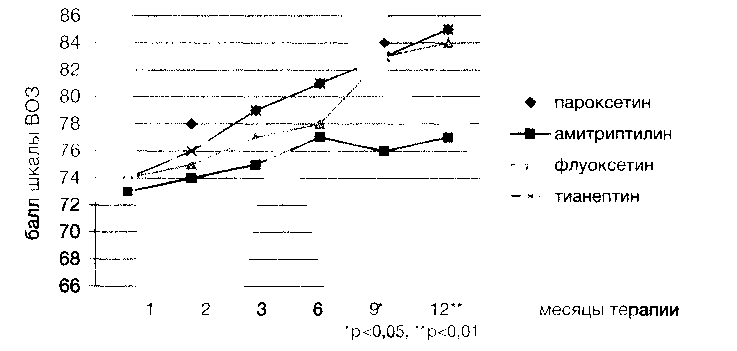
Рис 3. Сравнительная динамика качества жизни больных по шкале ВОЗ за 12 месяцев профилактической терапии ПАР, ТИА, ФЛУ, АМИ
Таким образом, различия показателей качества жизни и социального функционирования между пациентами, принимавшими АД нового поколения, и пациентами, принимавшими АМИ, по результатам исследования оказались существенными. В значительной степени более высокое качество жизни и восстановление социальной активности определялось более высокой чистотой ремиссии и значительно меньшим количеством НЯ при приеме АД нового поколения.
Сравнительная оценка выраженности депрессивной симптоматики по ШГ в процессе профилактической терапии не выявила каких-либо различий между исследуемыми препаратами, кроме различий по показателя «критика к заболеванию», которые оказались статистически значимыми (рис. 4). Так, на 2-й месяц терапии, то есть в период формирования качественной ремиссии, значение этого показателя ШГ во всех группах существенно уменьшалось, что соответствовало большей критичности к болезни.
Однако, начиная с 4 месяца, в группах ПАР, ФЛУ и ТИА критичность к болезни постепенно снижалась. Клинически в этот период времени пациенты начинали высказывать сомнения в наличии у них хронического заболевания, исчезали имевшие место ранее опасения развития рецидива. В одном случае это привело к отказу от противорецидивной терапии, в других случаях длительная терапия была продолжена после проведения психообразовательной беседы.
В отличие от АД нового поколения при лечении АМИ существенной динамики этого показателя не наблюдалось до конца исследования. Клинически на всем протяжении терапии у пациентов сохранялось осознание болезни, что поддерживалось наличием субдепрессивной симптоматики или НЯ.
К 11-12 месяцам терапии различия между группами АМИ и АД нового поколения по показателю «критика к наличию заболевания» достигали статистической значимости (р<0,05).
Известно, что в клинической практике глобальная эффективность профилактической терапии связана не только с непосредственной противорецидивной эффективностью лекарственного препарата, но и такими факторами как толерантность к препарату, критичность к своему заболеванию, осознание необходимости приема назначенной терапии, соблюдение ее режима и т. д. В условиях исследования такая глобальная эффективность профилактической терапии наглядно может быть отражена показателем «выживаемости» пациентов в исследовании по методу Каплана-Мейера (рис. 5).
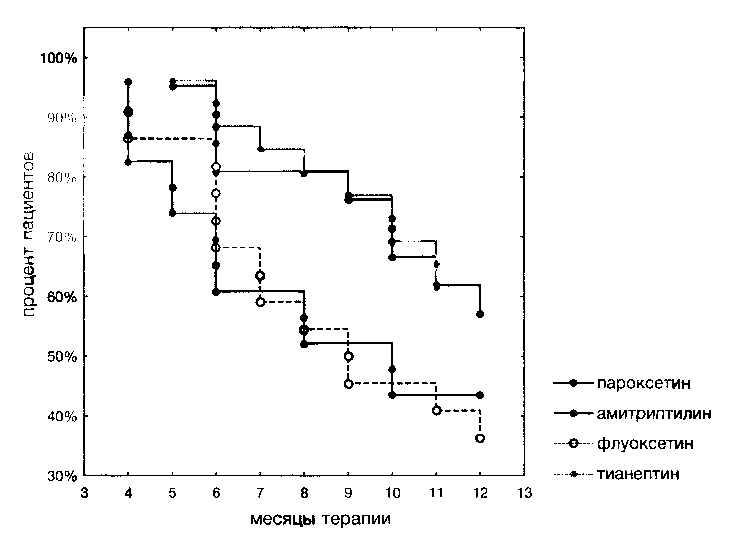
Рис. 5. Сравнительная эффективность длительной терапии АД нового поколения и AM И по показателю выбывания больных из исследования (анализ Каплана-Мейера)
Из графика видно, что по показателю «выживаемости» исследуемые группы имели значительные различия, которые, однако, не достигали степени статистической значимости. Так, до 12 месяца исследования в группе ТИА дошло 63%, в группе ПАР — 58% больных, ФЛУ — 37%, в группе AM — 41%.
В период профилактической терапии во всех группах встречались НЯ, их длительность и выраженность тщательно регистрировались. Данные о распространенности НЯ приведены в таблице 4.
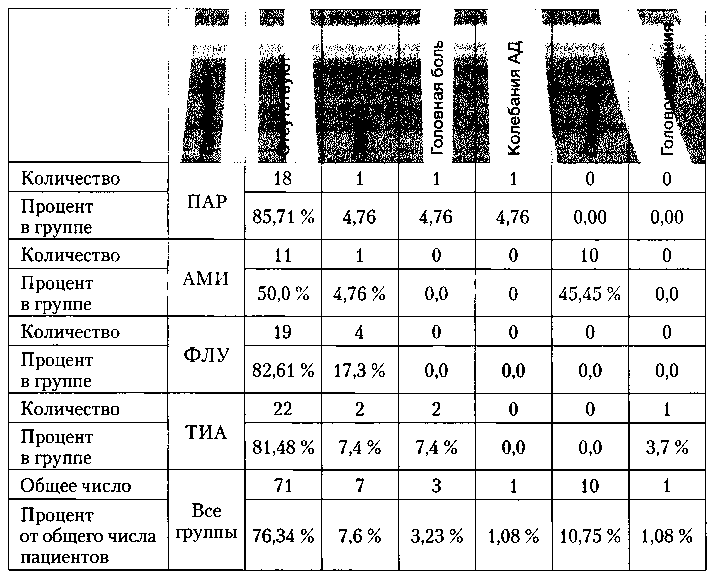
Таблица 4. Частота нежелательных явлений в группах ПАР, ТИА, ФЛУ, АМИ в процессе профилактической терапии
В группах пациентов, принимавших ПАР и ТИА, НЯ были редки и не являлись причиной выбытия пациентов из исследования. В группе пациентов, принимавших ФЛУ, НЯ встречались несколько чаще (17,3%). Все они были связаны с нарушениями деятельности желудочно-кишечного тракта (ЖКТ), незначительны по выраженности и не приводили к выбыванию пациентов из исследования. В группе пациентов, принимавших АМИ, уровень НЯ оказался существенно выше. Холинолитических НЯ оказалось немного (5%).
Это связано с тем, что холинолитические НЯ выявлялись на ранних этапах антидепрессивной терапии и становились причиной отмены препарата либо проходили самостоятельно ко времени перехода на профилактическую терапию. Существенной проблемой для профилактической терапии АМИ явилась дневная седация, которая часто становилась причиной уменьшения дозы профилактической терапии (у 45,5% пациентов). Пациенты жаловались на сонливость в дневное время и связанную с ней интеллектуальную заторможенность.
В одном случае это явилось причиной отказа пациента от участия в исследовании (6-й месяц терапии). Несколько пациентов самостоятельно изменяли схему терапии, уменьшая дозу препарата. Таким образом, в группах больных, принимавших АД нового поколения, частота НЯ была статистически достоверно ниже (р<0,01) по сравнению с группой пациентов, принимавших АМИ.