Классификация имеет большое значение для практики, так как позволяет прогнозировать эффективность и переносимость той или иной группы антипсихотиков и на этом основании проводить дифференцированный выбор терапии. Однако классификация также не лишена недостатков. При схожести профилей биохимической активности с клинических позиций вряд ли правомерно отнесение к одной группе сульпирида, амисульприда и галоперидола в силу различий силы антипсихотического эффекта и риска экстрапирамидных расстройств, или клозапина и кветиапина из-за выраженного различия силы антипсихотического эффекта.
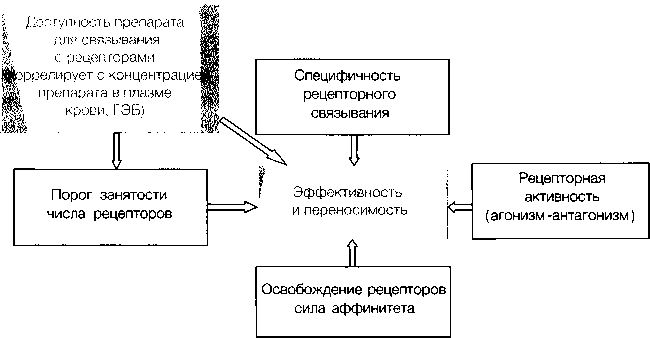
Эти особенности клинического действия препаратов связаны с другими индивидуальными фармакодинамическими параметрами. На эффективность и переносимость, помимо специфичности рецепторного связывания, влияют порог занятости числа рецепторов (клинический эффект наступает при блокаде более 60-70% рецепторов), рецепторная активность (агонизм-антагонизм) и сила аффинитета к рецепторам в разных структурах мозга, которая определяется временем диссоциации (освобождения) молекулы препарата из мест рецепторного связывания (рис.З). Например, сульпирид в небольших дозах связывается преимущественно с пресинаптическими D3-рецепторами, которые усиливают выброс дофамина и вызывают парадоксальный дезингибирующий, активирующий эффект, а кветиапин слабо блокирует D2-рецепторы и быстро высвобождается из мест связывания, что в клинике проявляется относительно слабым антипсихотическим эффектом и полным отсутствием ЭПС. Кроме того, аффинитет отдельных рецепторов к D2-рецепторам в различных структурах мозга может отличаться. Имеют значение и доступность препарата для связывания с рецепторами, которая коррелирует с концентрацией препарата в плазме крови и церебро-спинальной жидкости (рис. 3), в частности рисперидон и его метаболит (палиперидон) плохо проникают через гематоэнцефалический барьер (ГЭБ), и чтобы обеспечить эффективную блокаду D2-рецепторов в лимбических структурах, его концентрация в крови должна быть выше, чем у других препаратов, что повышает вероятность блокады этих рецепторов в гипофизарной области, которая, как известно, находится за пределами гематоэнцефалического барьера и непосредственно омывается кровью.
Недавно была создана новая группа антипсихотических средств, обозначаемых как «частичные агонисты дофаминовых рецепторов». Пока в ней только один препарат арипипразол, проходят клинические исследования бифепрунокса, карипразина, аплиндора и синтез новых средств. Имеются указания, что амисульприд возможно также является частичным агонистом D2-рецепторов (Stahl, 2009). Отличие частичных агонистов дофаминовых рецепторов от других антипсихотиков заключается в том, что они стабилизируют дофаминергическую трансмиссию на определенном уровне: при избытке дофамина они ее понижают за счет блокады D2-рецепторов, ослабляя проявления психоза, а при его дефиците (в корковых структурах) стимулируют ее за счет собственной внутренней активности молекулы, что проявляется ослаблением апато-абулической симптоматики. При этом риск неврологических и эндокринных расстройств при их приёме очень низкий. Данные особенности позволяют рассматривать частичные агонисты дофаминовых рецепторов в качестве «антипсихотиков III поколения» (рис. 2).
Ведется активный поиск новых лекарственных средств с антипсихотической активностью, в том числе с недофаминовым механизмом действия (рис. 2), включая различные рецепторные мишени в рамках глутаматергической, холинергической, серотонинергичес-кой, ГАМК-ергической, нейропептидной, канабиноидной и других нейромедиаторных систем мозга (Tandon et al., 2010). В частности, были получены первые обнадеживающие результаты клинической эффективности агонистов метаботропных mGlu2/3-рецепторов (Patil et al., 2007; Мосолов С. Н. с соавт., 2010), поддерживающие глутаматергическую гипотезу развития шизофрении (Conn et al., 2009, Stone, 2011). В дальнейшем, по-видимому, терапия шизофрении будет более дифференцированной и не сможет ограничиваться только применением препаратов одного класса, а именно дофаминблокирующих антипсихотиков. В соответствии с современным дименсиональным подходом уже разрабатываются прицельные способы более эффективного воздействия на первичную негативную симптоматику и когнитивный дефицит (Kim et al., 2009; Tandon et al., 2010). Среди потенциально интересных агентов в активном изучении находятся:
- агонисты D1-рецепторов (Zhang et al., 2009);
- дофаминстимуляторы (Marino et al., 2009);
- ингибиторы катехол-0-метилтрансферазы (КОМТ) (Roussos et al., 2009);
- антагонисты 5-HT6 рецепторов (Rose, Schaffhauser, 2010);
- антагонисты NMDA рецепторов — мемантин, рилузол (Lieberman et al., 2009);
- агонисты глициновых рецепторов — D-циклосерин, глицин, D-серин, небостинел, неголамин (Labrie, Roder, 2010);
- ингибиторы транспортера глицина (GluT,) — саркозин и другие препараты (Javitt, 2009);
- ингибиторы D-аминооксидазы (Tandon et al., 2010);
- антагонисты метаботропных mGLu1/5-рецепторов — акомпрозат (Lesage, Steckler, 2010);
- агонисты АМРА рецепторов — фанампатор и другие (Tandon et al., 2010);
- агонисты мускариновых рецепторов — N-десметилклозапин, ксаномелин, сабкомелин и другие (Raedler et al., 2007; Bradley et al., 2010; Leach et al., 2010; Money et al., 2010);
- агонисты никотиновых рецепторов — варенициллин, изопропициллин и другие (Money et al., 2010; Haydar, Dunlop, 2010);
- агонисты ГАМК-тиагабин и другие (Charych et al., 2009; Geffen et al. 2009);
- антагонисты а2-адренорецепторов — идазоксан, дексефароксан (Marcus et al., 2005; Tandon et al., 2010);
- антагонисты H3 гистаминовых рецепторов (Tiligoda et al., 2009); нейрокинин-3 (NK3) антагонисты — осапетант, тадпетант и другие (Dawson, Smith, 2010);
- антагонисты канабиноидных рецепторов — каннабидиол (Rose et al., 2010);
- нейростероиды и селективные модуляторы эстрогенных рецепторов (Bortolato et al., 2008; Ritsner, 2010);
- каппа-опиоидные агонисты (Yoshikawa et al., 2009).
Определенный интерес представляет также эпигенетическая стратегия с попыткой изменить генную экспрессию, в частности, путем применения ингибиторов метил-трансферазы и гистондеацетилазы (Deutch et al., 2008; Grayson et al., 2010), а также использование противовоспалительных, антибактериальных и противовирусных средств (целекоксиб, ингибиторы циклооксигеназы и фосфолипазы — миноциклин, валоцикловир, цефтриаксон) (Fatemi et al., 2009; Muller, 2010; Levkovitz et al., 2010).
Для практических врачей основное значение имеют классификации, основанные на различии клинических эффектов нейролептиков: выраженность общего антипсихотического действия, спектр психотропной активности, профиль побочных эффектов. Эти классификации значительно облегчают индивидуальный выбор терапии в практической деятельности.
В спектре клинической активности антипсихотиков выделяют несколько определяющих параметров:
- глобальное антипсихотическое (инцизивное) действие — способность препарата равномерно редуцировать различные проявления психоза и препятствовать прогредиентности заболевания;
- первичное седативное (затормаживающее) действие, необходимое для быстрого купирования галлюцинаторно-бредового или маниакального возбуждения, сопровождается глобальным депримирующим действием на ЦНС, в том числе явлениями бра-дипсихизма, нарушениями концентрации внимания, снижением вигилитета (уровня бодрствования) и гипнотическим действием;
- избирательное (селективное) антипсихотическое действие -связано с преимущественным воздействием на отдельные симптомы-мишени состояния, например, на бред, галлюцинации, расторможенность влечений, нарушения мышления или поведения; обычно развивается вторично вслед за глобальным антипсихотическим эффектом;
- активирующее (растормаживающее, дезингибирующее и антиаутистическое) антипсихотическое действие — обнаруживается, прежде всего, у больных шизофренией с негативной (дефицитарной) симптоматикой;
- когнитотропное действие проявляется при применении атипичных антипсихотиков в их способности улучшать высшие корковые функции (память, внимание, исполнительские функции, коммуникативные и другие познавательные процессы);
- депрессогенное действие — способность некоторых, преимущественно седативных антипсихотиков при длительном применении вызывать специфические (заторможенные) депрессии; Некоторые препараты (например, кветиапин, оланзапин, арипипразол, зипрасидон, тиоридазин, флупентиксол, сульпирид и др.) обладают определенной способностью редуцировать депрессивную симптоматику у больных шизофренией.
- неврологическое (экстрапирамидное) действие — связано с влиянием на экстрапирамидную систему мозга и проявляется неврологическими нарушениями — от острых (пароксизмальных) до хронических (практически необратимых); неврологическое действие минимально у атипичных антипсихотиков;
- соматотропное действие — связано, в основном, с выраженностью адренолитических и антихолинергических свойств препарата. Проявляется в нейровегетативных и эндокринных побочных эффектах, в том числе гипотензивных реакциях и гиперпролактинемии.
Наибольшее значение при выборе нейролептика имеет соотношение первых двух параметров, т. е. глобального антипсихотического и первичного седативного эффектов (табл. 3), на основании чего выделяют:
- группу седативных антипсихотиков (левомепромазин, хлорпромазин, промазин, хлорпротиксен, алимемазин, перициазин и др.), которые независимо от дозы, сразу вызывают определенный затормаживающий эффект;
- препараты с мощным глобальным антипсихотическим действием или инцизивные антипсихотики (галоперидол, зуклопенти-ксол, пипотиазин, тиопроперазин, трифлуоперазин, флуфеназин), которым при применении в малых дозах свойственны активирующие эффекты, а с нарастанием дозы возрастают и их купирующие психотическую (галлюцинаторно-бредовую) и маниакальную симптоматику свойства;
- дезингибирующие антипсихотики (сульпирид, карбидин и др.), преимущественно (т. е. в большом диапазоне доз) обладающие растормаживающим, активирующим действием;
- в силу особого механизма действия и спектра психотропной активности отдельную группу составляют атипичные антипсихотики (клозапин, оланзапин, рисперидон, кветиапин, амисульприд, зипрасидон, сертиндол, арипипразол, палиперидон, азенапин и др.), которые, обладая отчетливым антипсихотическим эффектом, не вызывают или вызывают дозозависимые экстрапирамидные расстройства и способны корригировать негативные и когнитивные нарушения у больных шизофренией.
При замене одного антипсихотика другим следует руководствоваться следующими примерными эквивалентами дозировок для приема внутрь (так называемые аминазиновые эквиваленты) (см. табл.З).
Приведенные дозы и аминазиновые эквиваленты используются при пероральном приеме препаратов, в случае парентерального введения дозу следует уменьшить в среднем в 2 раза. Подбор более высоких доз должен проводиться в специализированных учреждениях. Приведенные аминазиновые эквиваленты не могут быть экстраполированы на максимальные дозы препаратов.
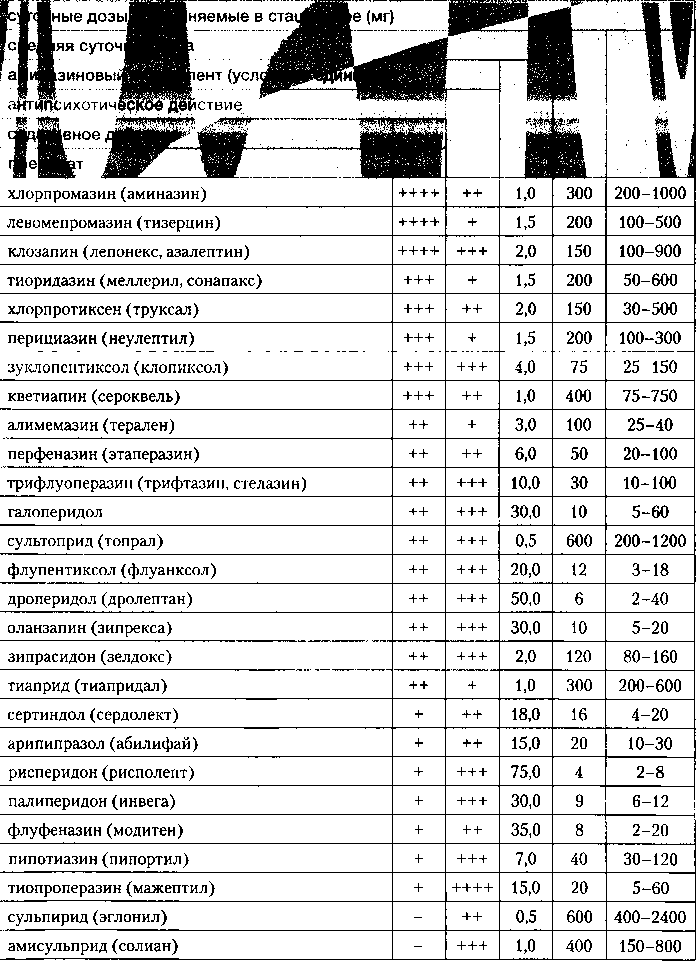
Таблица 3. Спектр психотропной активности, дозы и хлорпромазиновые (аминазиновые) эквиваленты антипсихотических средств
Примечание:
++++ сильное (максимально выраженное) действие;
+++ выраженное;
++ умеренное;
+ слабое;
— отсутствует.
В соответствии с концепцией аминазиновых эквивалентов, которые в целом соответствуют силе связывания препарата с D2-рецепторами, все нейролептики представляются взаимозаменяемыми и делятся на низкопотентные, требующие применения высоких терапевтических доз и имеющие маленький аминазиновый эквивалент (к ним относятся преимущественно седативные нейролептики), и высокопотентные, при применении которых аналогичный антипсихотический эффект достигается с использованием более низких дозировок. В эту группу попадают преимущественно мощные, инцизивные нейролептики, имеющие соответственно высокий аминазиновый эквивалент и способные предотвращать прогрессирование шизофренического процесса.
При проведении терапии и подборе доз имеют значение некоторые фармакокинетические параметры (см. табл. 4). Большинство антипсихотиков при пероральном приеме быстро всасываются из желудочно-кишечного тракта и подвергается экстенсивному печеночному метаболизму. Задействованные при этом изоэнзимы цитохрома Р450 для АА приведены в таблице 4. Препараты ингибирующие эти субстраты (например, большинство селективных ингибиторов реаптейка серотонина) могут повышать концентрацию препарата в плазме крови. После глюкуронирования в печени метаболиты выводятся с мочей и калом. Единственными препаратами среди АА, которые подвергаются незначительному метаболизму в печени и выводятся почками в неизмененном виде, являются амисульприд и палиперидон. Как правило, активное вещество обладает высокой липофильностью и легко проникает через гемато-энцефалический барьер. Период полувыведения основных АПП (галоперидол, хлорпромазин) составляет около суток, пик концентрации в плазме крови достигается через 3-4 часа, метаболизм осуществляется преимущественно изоэнзимами 2D6 и 3 А4.
Отмена антипсихотических препаратов должна проводиться постепенно под тщательным контролем врача во избежание риска развития синдрома отмены или обострения симптоматики.