В данной статье предоставлен обзор доказательных рандомизированных клинических исследований по оценке эффективности и переносимости атипичных антипсихотиков при купировании острых маниакальных состояний в рамках гиизоаффективного и биполярного расстройств. Он показывает, что преимущество атипичных антипсихотиков по сравнению с традиционными нейролептиками заключается не столько в эффективном контроле психомоторного возбуждения и других маниакальных симптомов, сколько в их лучшей неврологической переносимости. Так же продемонстрированы данные отечественного исследования по купированию маниакальных состояний рисперидоном, оланзапином, кветиапином, зипрасидоном, галоперидолом, галоперидолом+литий с участием 129 пациентов. Результаты, полученные в отношении действия сравниваемых препаратов на маниакальную симптоматику, согласуются с данными других авторов. Анализ действия терапии атипичными антипсихотиками позволил выявить равную эффективность между препаратами, лучшую неврологическую переносимость и отсутствие депрессогенного действия по сравнению с типичным нейролептиком галоперидолом. Монотерапия атипичными антипсихотиками не уступает по эффективности традиционным схемам лечения, а в сочетании с нормотимиками атипичные антипсихотики в ряде случаев позволяют добиться большего успеха. Вместе с тем, при применении атипичных антипсихотиков нередко развиваются нейроэндокринные и метаболические нарушения, что необходимо учитывать при выборе антиманиакальной терапии.
Появление новых лекарственных препаратов, в том числе атипичных антипсихотиков, существенно расширило возможности терапии острых маниакальных состояний (МС). Однако, до настоящего времени задача купирования МС остается одной из наиболее сложных а практике врачей-психиатров. Для успешного купирования МС необходимо решение целого комплекса терапевтических проблем. К ним относятся и необходимость максимально быстрого воздействия на маниакальную, а часто и на психотическую симптоматику, и купирование психомоторного возбуждения и агрессивности, и нормализация сна, а также и предотвращение инверсии фазы (Esparon J. et al., 1986; Zarate C., Tohen M, 2004). Важность быстрого достижения результата терапии очевидна, если принять во внимание выраженные нарушения поведения, характерные для статуса маниакального пациента, и среднюю продолжительность маниакального эпизода, которая даже при квалифицированной помощи, составляет, в среднем, 10 недель (Kupfer D. et al, 2000).
„Золотым стандартом» при купировании маниакальных состояний в настоящий момент являются препараты нормотимического действия (соли лития, соли вальпроевой кислоты, карбамазепин). Они применяются в виде монотерапии или в комбинации с классическими нейролептиками (галоперидолом), которая используется при выраженном психомоторном возбуждении и при маниакальнобредовых состояниях (Vestergaard Р., 1992; Chou J., 1996; Tohen М., Zhang Е, 2001; Baldessarini R., Tarazi F., 2005; Мосолов С. H., 1983). По данным Goodwin Е (1990), Hirschfeld R. (2003) около 50 % маниакальных эпизодов сопровождается бредовой симптоматикой* 15% -галлюцинаторной и 20 % — острыми расстройствами мышления. В этих случаях нормотимическая терапия используется в сочетании с антипсихотиками.
Включение в схему лечения МС классических нейролептиков нередко приводит к развитию экстрапирамидной симптоматики, осложняющей проведение терапии. Также возможно появление специфических для лития побочных эффектов, которые могут усиливаться при комбинированной терапии (Cavazzoni et al., 2006; Mukherjee et al., 1986; Мосолов С. H., 1983). Кроме того, существует риск развития инверсии фазы, который особенно высок при шаблонной нейролептической терапии. Все вышеперечисленные факторы повышают количество госпитализаций пациентов с МС, снижают качество жизни и приводят к инвалидизации в молодом возрасте (Sierra Р., 2005; Rosa А., 2009; Sanchez-Moreno J., 2009). Представляет определенные трудности и терапия смешанных состояний, в структуре которых чаще, чем при чистой мании, отмечаются психотические симптомы, а также высокий риск суицида. Актуальность поиска новых методов, позволяющих оптимизировать терапевтическую тактику и улучшить соблюдение больными режима терапии, определяется рядом причин.
Классические нейролептики по многим показателям уступают атипичным антипсихотикам и все больше вытесняются ими в клинической практике. Атипичные антипсихотики уже стали средством выбора при лечении шизофрении, эффективно воздействуя как на продуктивную, так и на негативную симптоматику и, по сравнению с традиционными нейролептиками, вызывая значительно меньшее количество неврологических побочных эффектов.
В последние годы активно изучается спектр психотропной активности атипичных антипсихотиков (АА). Ряд публикаций последних лет сообщает о результатах рандомизированных, плацебо-контролируемых исследований, а также менее сложных по дизайну открытых клинических исследований, в которых оценивалась способность АА (клозапина, рисперидона, оланзапина, кветиапина, зипрасидона и арипипразола) редуцировать МС при биполярном аффективном расстройстве (БАР). Применение атипичных антипсихотиков при БАР решает 3 основные задачи:
- купирование психотической (галлюцинаторно-бредовой) симптоматики,
- контроль психомоторного возбуждения (этому способствует появление лекарственных форм для в/м введения),
- достижение собственно антиманиакального эффекта.
По мнению Meltzer Н. (1998), преимущества АА в лечении БАР заключаются не только в возможности эффективного купирования маниакальной симптоматики при более высокой переносимости, но и в потенциальной возможности предотвращения инверсии фазы и рецидивов аффективной симптоматики в процессе длительной профилактической терапии, ставшей возможной вследствие значительного снижения риска развития поздней дискинезии. Кроме того, известно, что механизм действия АА отчасти связан с блокадой 5-НТ2А-серотониновых рецепторов, что теоретически может объяснять их нормотимический эффект.
Целью настоящего обзора является оценка сравнительной эффективности и переносимости второго поколения антипсихотических средств (атипичных антипсихотиков) при лечении маниакальных и маниакально-бредовых состояний (МС) на основе анализа рандомизированных контролируемых исследований в соответствии с принципами доказательной медицины.
Первый АА, клозапин (КЛЗ), дольше других современных антипсихотических средств используется в клинической практике, особенно при резистентных состояниях и недостаточной эффективности традиционной нейролептической терапии. На сегодняшний момент опубликованы результаты нескольких открытых клинических исследований КЛЗ, проведенных на небольших выборках больных БАР, а также множество сообщений о случаях его использования для лечения различных форм МС. Рандомизированных, плацебоконтролируемых исследований применения КЛЗ у данной категории больных нами не обнаружено. Так, в открытых проспективных исследованиях (McElroy S.,1991; Calabrese J., 1996; SuppesT., 1999; Masi G., 2002) на небольших выборках больных изучили эффективность КЛЗ при лечении пациентов с резистентными МС в рамках БАР I типа и шизоаффективного расстройства. В целом, исследователи отмечают существенную редукцию симптоматики по Шкале краткой психиатрической оценки BPRS (Overall J., 1962) и Шкале Янга для оценки маниакального состояния YMRS (Young R., 1978). Однако, несмотря на хорошие результаты терапии КЛЗ, риск развития тяжелого побочного эффекта — агранулоцитоза при длительном приеме ограничивает возможности его применения. У большинства больных в процессе терапии также отмечались гиперсаливация, сонливость, запоры, повышение аппетита и увеличение веса тела.
В плацебо-контролируемых исследованиях, спланированных и проведенных по высокодоказательным методикам и на больших выборках, была продемонстрирована эффективность при лечении МС и разрешено практическое применение другого АА — олан-запина (ОЛЗ). Главным критерием для оценки эффективности ОЛЗ при МС было изменение суммарного балла шкалы YMRS (по 11 пунктам) и тяжести МС по шкале CGI-BP (Шкала глобального клинического впечатления в модификации для биполярного расстройства) в процессе терапии (Tohen М., 2001, 2003, 2007,2008; Perils R., 2006; Niufan G„ 2008).
В двух из проведенных исследований эффективность ОЛЗ сравнивалась с плацебо. Так, в рандомизированном, плацебо-контролируемом исследовании Tohen М., 1999 была проанализирована эффективность и безопасность фиксированной дозы ОЛЗ (10 мг/сут) (п=70) по сравнению с плацебо (п=69) при лечении 139 пациентов с острым МС. Ограниченно разрешались к применению лоразепам и бензтропин. Результаты показали, что через 3 недели терапии в группе, получавшей ОЛЗ, 39 % пациентов выбыли из исследования из-за неэффективности лечения, а в группе, получавшей плацебо, — 65 %. Редукция маниакальной симптоматики по шкале YMRS оказалась значительно выше в группе, принимавшей ОЛЗ, однако до 3-й недели терапии различия не были статистически достоверны, что указывает на отставленное развитие антиманиакального эффекта препарата. Кроме того, больные, получавшие плацебо, нуждались в более высоких средних дозах лоразепама (1,1 мг/сут против 1,7 мг/сут, соответственно). Число респондеров (50% редукции симптоматики по шкале YMRS) к концу исследования в группе, получавшей ОЛЗ, составило 48,6%, в группе плацебо — 24,2%.
Другое двойное слепое, плацебо-контролируемое исследование, проведенное Tohen М., 2000, было более продолжительным по времени (4 недели терапии), и ОЛЗ применялся в фиксированной дозе — 15 мг/сут. Были включены 115 пациентов с диагнозом БАР I, маниакальное или смешанное состояние, использовались такие же, как в предыдущем исследовании, методы оценки результатов. ОЛЗ в дозе 15 мг/сут оказался более эффективен, а число респондеров (64,8 %) было больше по сравнению с группой, получавшей плацебо (42,9%), и превосходило количество респондеров в исследовании, где ОЛЗ применялся в дозе 10 мг/сут (Tohen М., 1999). Пациентов, прекративших прием препаратов из-за неэффективности терапии, было статистически достоверно больше в группе, получавшей плацебо (58,3%), чем в группе, получавшей ОЛЗ (38,2%). Кроме того, в группе плацебо после 4 недель терапии отмечалось усиление симптомов ажитации. Таким образом, можно считать статистически достоверно доказанной большую эффективность ОЛЗ по сравнению с плацебо при купировании МС у больных БАР.
В других исследованиях монотерапия ОЛЗ сравнивалась с нормотимиками — карбонатом лития (КЛ) или дивальпроексом натрия (ДВН). В исследованиях Berk М (1999), Tohen М., (2002); Zajecka J., (2002) респондеров (50 %- редукция среднего балла по шкале YMRS) было статистически достоверно больше в группе, принимавшей ОЛЗ (48,9 %), по сравнению с группой, получавшей ДВН (37 %).
Следует отметить, что во всех исследованиях сообщалось о значительной прибавке в весе у больных, принимавших ОЛЗ, в среднем от 1,65 до 4 кг. Кроме того, наблюдались сонливость, отек слизистой носа, дизартрия, сухость во рту, головокружение, тремор, ригидность мышц шеи, бессонница. Анализируя результаты исследований, в которых ОЛЗ применялся в качестве монотерапии при купировании МС, можно отметить, что довольно большое число пациентов (30-40 %) прекращали терапию на ранних этапах по причине неэффективности или побочных эффектов. Тем не менее, полученные результаты показывают, что ОЛЗ при купировании МС по сравнению с плацебо обладает отчетливо выраженными антиманиакальными свойствами и не уступает по эффективности и срокам начала действия традиционной нормотимической терапии.
В настоящий момент при купировании психомоторного возбуждения у больных, в том числе и при МС, изучается возможность использования инъекционной формы ОЛЗ. Так, в рандомизированном исследовании Meehan К., 2001, было показано, что у пациентов (n=99), получивших 3 в/м инъекции ОЛЗ (10 мг) в течение 24 часов, наблюдалась значительно более выраженная редукция психомоторного возбуждения, оцененная по шкале PANSS (Kay S., 1987), по сравнению с пациентами, получавшими лоразепам (п=51) или плацебо (п=51). В исследовании Centorrino Е, 2007, были получены схожие результаты. Для достижения редукции психомоторного возбуждения у 90 % пациентов (n=22) была сделана одна инъекция ОЛЗ (10 мг) за 24 часа, у 50% из которых, снижение возбуждения произошло в первые 30 минут после инъекции. Кроме того, у 51 % больных, получавших в/м лоразепам, наблюдались нежелательные побочные явления, по сравнению с ОЛЗ (43,3%) и плацебо (25,5%). Полученные результаты согласуются с данными King К. (2002), изучавшими эффективность, безопасность и кардиотоксический эффект в/м иньекций ОЛЗ по сравнению с галоперидолом и плацебо при купировании острой ажитации в рамках МС. Было показано, что значения интервала QT на ЭКГ в группе, получавшей ОЛЗ, изменялись очень мало и были сопоставимы с плацебо группой.
Помимо вышеописанных работ, был проведен ряд менее крупных и менее сложных по дизайну клинических сравнительных исследований эффективности и переносимости ОЛЗ при МС. Так, в двойном слепом исследовании, проведенном Baker R. (2002), оценивалась возможность быстрого наращивания дозы ОЛЗ, по сравнению с лоразепамом, для купирования ажитации при МС. Была показана статистически значимая редукция среднего балла по шкале PANSS в обеих группах, а быстрое увеличение дозы оланзапина до 30-40 мг/сут в течение 4 дней признано авторами оправданным в этих случаях. Проводилась также оценка эффективности и безопасности применения ОЛЗ при купировании МС у детей и подростков. В открытом 8-недельном исследовании Frazier J. (2001) ОЛЗ применялся в дозе от 2,5 до 20 мг/сут при МС у детей и подростков (n=23) в возрасте от 5 до 14 лет. К концу терапии маниакальная симптоматика редуцировалась на 19,04±9,21 баллов по шкале YMRS (р<0,001), а респондерами являлись 60,9 % больных.
В последние годы в ряде высокодоказательных клинических исследований показана возможность применения сочетанной терапии ОЛЗ с карбонатом лития (КЛ) или дивальпроексом натрия (ДВН) при купировании МС. Так, в исследовании, проведенном Tohen М. (2002), комбинированная терапия (ОЛЗ+КЛ или ДВН) привела к редукции среднего балла по шкале YMRS на 58,8%, по сравнению с 40 % редукцией в группе, получавшей монотерапию нормотимиками. Респондеров в группе, принимавшей комбинированную терапию, было значительно больше, чем в группе, принимавшей монотерапию (67,7% и 44,7% соответственно) (р<0,01). Количество пациентов, достигших ремиссии (12 и меньше баллов по шкале Y-MRS), было также достоверно больше в группе сочетанной терапии — 78,6%, по сравнению с 65,8% в группе монотерапии. Анализ побочных эффектов показал, что у больных, получавших сочетанную терапию, наиболее частой жалобой была сонливость
(51 %). Кроме того, у них отмечалось статистически достоверное повышение веса тела (в среднем на 3 кг) по сравнению с 0,23 кг в группе, принимавшей монотерапию нормотимиком, а также сухость во рту, увеличение аппетита и дизартрия. Таким образом, проведенное исследование показало, что комбинированная терапия ОЛЗ и нормотимиком является достоверно более эффективной при острых МС по сравнению с монотерапией нормотимиком, хорошо переносится, хотя и вызывает большее число побочных эффектов, в частности, увеличение веса тела.
Рисперидон (РИС) также достаточно часто применялся при купировании МС в рамках БАР и шизоаффективного психоза. Наиболее доказательные результаты его эффективности представлены в 3 мультицентровых, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях. В первом исследовании, проведенном Hirschfeld R. (2003), пациенты (п=279) с МС были распределены в две терапевтические группы и получали РИС (1-6 мг/сут) или плацебо в течение 3 недель. В группе РИС исследование завершили 56% больных, а в группе плацебо — 42 %. Статистически значимая редукция симптоматики по шкале Y-MRS в конце исследования была отмечена только в группе РИС (-11,1±0,9 балла). Аналогичные результаты были получены в двойном слепом плацебо-контролируемых исследовании Khanna S. (2003), в котором пациенты (n=290) с маниакальным или смешанным состоянием в течение 3 недель также получали РИС (1-6 мг/сут) или плацебо. Статистически значимая редукция МС по шкале YMRS к концу исследования наблюдалась в группе РИС (-22,7±1,1 балла) по сравнению с группой плацебо (-10,5±1,3 балла). В плацебо-контролируемых исследовании Eerdekens М. (2003); Smulevich А. (2005) монотерапия РИС (1-6 мг/сут) сравнивалась с галоперидолом (4-12 мг/сут). Оказалось, что РИС по антиманиакальной эффективности сравним с галоперидолом, а респондерами через 3 недели терапии в группе РИС являлись 48 % больных, в группе галоперидола -47 %, а при приеме плацебо -33 % больных.
К настоящему моменту опубликованы результаты нескольких плацебо-контролируемых Vieta Е. (2000); Sachs G. (2002); Yatham L. (2003); Canuso С. (2003) и открытых проспективных исследований Bowden С. (2000); Petty F. (2000); Focas С. (2002) комбинированной терапии РИС и нормотимиков при МС. Так, по результатам исследований к концу 3-й недели терапии число пациентов, достигших 50 % редукции симптоматики по шкале YMRS (респондеры), было статистически значимо больше в группах, получавших РИС+нормотимик и галоперидол+нормотимик, чем в группе плацебо+нормотимик.
Оценивая профиль переносимости РИС, можно отметить, что во всех исследованиях сообщалось о побочных эффектах, в том числе экстрапирамидных симптомах. Так, по результатам исследования Sachs G. (2002) экстрапирамидные побочные эффекты наблюдались у 28 % больных в группе больных, принимавших галоперидол, у 13 % больных в группе РИС и у 4 % больных при приеме плацебо.
Кветиапин (КВТ) также активно исследовался при купировании МС. Эффективность монотерапии КВТ при МС подтверждена в трех рандомизированных, 12-недельных, двойных слепых, плацебо-контролируемых исследованиях. Так, в большом мультицентровом исследовании Jones М. (2003) было включено 604 пациента с МС в рамках БАР, из них 209 получали КВТ в дозе до 800 мг/сут, в контрольную группу входили пациенты, получавшие плацебо (n=198), галоперидол (n=99) или карбонат лития (п=98). Уже с 4-го дня терапии в группе КВТ отмечалось статистически значимое улучшение состояния больных по сравнению с группой плацебо, оцениваемое по шкале YMRS (р=0,021), а к 21-му дню терапии в группе больных, получавших КВТ, наблюдалась значительная редукция маниакальной симптоматики (р<0,001), сохраняющаяся и к 84 дню терапии (р<0,001). Галоперидол и карбонат лития также показали достаточную эффективность, однако в этих группах значительно чаще, чем в группах КВТ и плацебо, наблюдались побочные эффекты, в том числе ЭПС. В группе плацебо у больных отмечалась бессонница (20,2 %) и тревога (8,1 %). Больные, принимавшие КВТ, жаловались на сонливость (16,3%), сухость во рту (15,8%), однако таких побочных эффектов, как ЭПС и пролактинемия, не наблюдалось.
В плацебо-контролируемых исследованиях Brecher М. (2003), McIntyre R. (2005) также изучалась эффективность и переносимость монотерапии КВТ в дозе до 800 мг/сут у пациентов (п=302) с МС. После рандомизации больные в течение 12 недель получали кветиапин (n=102), плацебо (n=101) или галоперидол (n=99) в дозе до 8 мг/сут. На 21-й день терапии статистически значимая редукция среднего балла по шкале YMRS наблюдалась в группе больных, принимавших КВТ (12,3), по сравнению с плацебо группой (8,3). К 84-му дню терапии редукция симптомов мании в группе КВТ была еще более значительной и составила в среднем 17,5 балла, а в группе плацебо — только 9,5 балла. Респондерами в группе, получавшей КВТ, на 84-й день терапии являлись 62,4 % больных, что значительно больше по сравнению с плацебо-группой (39 % больных). По результатам исследования был сделан вывод, что КВТ не уступает по своей эффективности классическому нейролептику галоперидолу, однако значительно лучше переноситься больными. Так, было показано, что экстрапирамидные побочные эффекты отмечались у 59,6 % пациентов, получавших галоперидол, у 15,8% больных плацебо группы и лишь у 12,7% пациентов, принимавших КВТ. Из-за побочных явлений прекратили участие в исследовании 10,1 % больных в группе галоперидола, 5,9 % пациентов — в группе плацебо и 4,9 % — в группе, принимавшей КВТ, что еще раз доказывает его хорошую переносимость.
Заслуживают внимания данные еще одного плацебо-контролируемого исследования, проведенного Paulsson В. (2003), в котором также подтверждается эффективность КВТ при МС. Было показано, что на 21-й день терапии статистически значимая редукция среднего балла по шкале YMRS в группе больных, получавших КВТ, составила 14,6 балла, в группе плацебо — 6,7 балла, а к 84 дню терапии — 20,3 и — 9,0 баллов соответственно. Число респондеров на 21-й день терапии, также было значительно больше в группе больных, получавших КВТ, по сравнению с группой плацебо — 53 % и 24 %, а к концу исследования — 72%и41,1% соответственно. При дополнительной оценке эффективности препаратов, например, по Шкале Монтгомери-Асберга для оценки депрессии MADRS (Montgomery S. A., Asberg М., 1979), к концу исследования редукция среднего балла в группе КВТ составила 1,49, а в группе плацебо наблюдалось некоторое усиление симптомов депрессии (1,21 балла). Таким образом, по результатам трех двойных слепых, плацебо-контролируемых исследований можно сделать вывод, что монотерапия КВТ достаточно эффективна при МС в рамках БАР, а частота побочных эффектов при лечении КВТ мало отличается от плацебо.
Представляют также интерес результаты исследований, в которых КВТ применялся при купировании МС в сочетании с нормотимиками — карбонатом лития (КЛ) или дивальпроексом натрия (ДВН). В исследовании Sachs G. (2004); Mullen J. (2003) было показано статистически достоверное различие в редукции среднего балла по шкале Y-MRS при использовании КВТ в комбинации с нормотимиками (13,76 балла), по сравнению с плацебо+КЛ/ДВН (9,93 балла) (p=0,021). Количество больных, оцененных как респондеры по шкале YMRS, в группе сочетанной терапии составило 54 %, а в группе плацебо — 32 % (р=0,005).
Хороший профиль переносимости, низкая частота развития побочных эффектов сделали возможным применение КВТ у молодых пациентов 12-18 лет (DelBello М. R, 2002). КВТ применялся в средней дозе 250 мг/сут в сочетании с дивальпроексом натрия и показал достаточную эффективность в сравнении с монотерапией нормотимиком при купировании МС. Опубликованы также данные нескольких открытых проспективных исследований, в которых КВТ применялся при быстроциклическом течении — БАР (Ghaemi S., 2002; Vieta Е., 2002) и у маниакальных больных с кокаиновой зависимостью (Brown Е., 2002).
В последние годы внедряется в практику новая форма препарата: кветиапин длительного высвобождения (в России зарегистрирован под торговым названием „сероквель пролонг“). В фармакокинетических исследованиях было показано, что КВТ длительного высвобождения с однократным приемом препарата в течение суток приводит к той же общей экспозиции препарата, что и применение КВТ немедленного высвобождения, требующего 2-3 кратного приема за день. Удобство приема препарата и простота схемы лечения увеличивает комплаентность пациента и приверженность его к лечению, что помогает переводить таких пациентов после купирования острых состояний на поддерживающую терапию (Figueroa С., 2009; Meulien D., 2010; Velligan D., 2010).
В рандомизированном, 3-недельном, двойном слепом, плацебо-контролируемом исследовании Cutler А. (2011) при однократном приеме (вечером) КВТ длительного высвобождения использовался следующий режим дозирования препарата: первый день — 300 мг, второй — 600 мг. С 3 по 22 день доза была гибкой и составляла от 400 мг до 800 мг (средняя доза препарата составила 603,8 мг/сут.) В этом исследовании уже к 4 дню терапии было выявлено статистически значимое снижение среднего балла по шкале YMRS, р<0,001 (статистически значимое снижение наблюдалось в таких пунктах шкалы YMRS как: приподнятое настроение, увеличение моторной активности (энергичность), сон), и к концу исследования суммарное снижение среднего балла составило -14,34 балла в группе КВТ и -10,52 в группе плацебо, р<0,001 (раздражительность, речь (скорость и количество), содержание идей). На первой неделе в группе КВТ было выявлено 38,5 % респондеров и 23,9 % -в группе плацебо (р<0,01), к концу исследования количество респондеров в группе КВТ составило 55,0 %, группа плацебо — 33,3 % (р<0,001). Уже на первой неделе терапии количество пациентов, достигших критериев ремиссии (YMRS<12), в группе КВТ составило 28,4%, в группе плацебо — 18,2% (р<0,05). К концу исследования количество пациентов в группе КВТ увеличилось до 41,6%, а в группе плацебо до 27,7 % (р<0,01). В данной работе около 40% пациентов наблюдались со смешанным маниакальным состоянием. И одним из критериев эффективности было изменение среднего балла шкалы депрессии MADRS. Статистически достоверно снижение среднего балла по данной шкале было значительнее в группе КВТ, по сравнению с группой плацебо, -4,36 и -1,94, соответственно (р<0,005). Процент выбывших досрочно из данного исследования в обеих группах терапии был примерно одинаков: КВТ — 28,4 %, плацебо — 28%. Среди побочных эффектов терапии в группе КВТ преобладали седация (34,4%), сухость во рту (33,8%), сонливость (16,6%), в группе плацебо — головная боль (13,8%), седация (7,5%), сухость во рту (6,9 %). Так же в группе КВТ отмечалось увеличение уровня пролактина и увеличение веса в среднем на 1,3 кг, тогда как в группе плацебо — на 0,1 кг. У 5% пациентов, принимавших КВТ, было отмечено увеличение веса более чем на 7 % от первоначального веса, зафиксированного до начала приема препарата.
Новый атипичный антипсихотик зипрасидон (ЗИП) изучался в виде монотерапии в двойных слепых плацебо-контролируемых исследованиях при лечении МС у больных БАР. Так, по данным Keck Р. (2003), уже на 2-й день терапии отмечалось улучшение состояния пациентов. Статистически значимая редукция среднего балла по шкале YMRS была выше в группе ЗИП (12,4±12,0) по сравнению с группой плацебо (7,8±12,9), р<0,005. Редукция маниакальной симптоматики по шкале YMRS к концу исследования составила 50% в группе, принимавшей ЗИП, что статистически достоверно выше, чем в группе плацебо (35%). В исследовании Segal J. (2003) респондерами в группе ЗИП являлись 46 % больных, а в группе плацебо — 21 % пациентов. В большом мультицентровом исследовании Vieta Е. (2010) было включено 438 пациента с МС в рамках БАР, из них 138 получали ЗИП в средней дозе 116,2 мг/сут, в контрольную группу входили пациенты, получавшие плацебо (n=88), галоперидол (ГАЛ) (п=171) (средняя доза — 16,0 мг/сут). ЗИП и ГАЛ на второй день терапии статистически достоверно превосходили плацебо по редукции среднего балла по шкале YMRS (р=0,001), это же превосходство наблюдалось на 21-й день терапии (р<0,001), а ГАЛ был более эффективен, чем ЗИП (р<0,001). В эти же сроки были выявлены респондеры: 36,9 % в группе ЗИП, 54,7 % — ГАЛ,
20,5 % — плацебо (р<0,05). В первые три недели терапии не было выявлено изменений показателей по шкалам депрессии MADRS и HAMD. Однако к концу 12 недели у 3,4 % пациентов, получавших терапию ЗИП, и 8,2 % — ГАЛ было отмечена инверсия фазы, с увеличением выраженности депрессивной симптоматики. Среди побочных явлений преобладала экстрапирамидная симптоматика (явления паркинсонизма, акатизия). Так, к концу третьей недели ЭПС была выявлена у 19,1 % пациентов, принимавших ЗИП, 30,4 % — ГАЛ, 8 % -плацебо, на 12-й недели терапии эти показатели увеличились до 23% в группе ЗИП и до 35,1 % в группе ГАЛ. В данной работе отмечалось быстрое начало действия ЗИП. По этому показателю ЗИП был сопоставим с ГАЛ, однако уступал ему по эффективности к концу третьей недели. К концу 12-й недели терапии ЗИП превосходил ГАЛ по характеристикам безопасности с меньшим числом инверсий фазы.
В сочетании с КЛ при купировании МС ЗИП оказался сопоставим по эффективности с монотерапией КЛ (Weisler R., 2003), что показывает необходимость дополнительных исследований по изучению назначения ЗИП совместно с нормотимической терапией. Самой частой жалобой больных, принимавших ЗИП, была сонливость (37 %), отмечались также головная боль, головокружение, повышение АД, тошнота и акатизия. Повышение веса тела не наблюдалось ни в одном случае.
Важным преимуществом ЗИП в выборе терапии при купировании МС является наличие у него инъекционной формы для в/м введения (Daniel D., 2001,2004; Preval Н., 2005; Brook S., 2005).
В последние годы появилось много данных об эффективности другого нового АА арипипразола (АРП) при МС (Carson W., 2004; Bourin М., 2004; Sachs G., 2007). Keck P. с соавт. (2003) изучали арипипразол в сравнении с плацебо в условиях 3-недельного мультицентрового исследования двойным слепым методом. 262 больных с обострением маниакального состояния получали 30 мг арипи-празола в течение 21 дня. Результаты исследования показали, что арипипразол продемонстрировал статистически значимое снижение показателей кластеров мании по сравнению с группой плацебо. Уже к 4 дню терапии редукция баллов по шкале YMRS в группе арипипразола было значительно больше, чем в группе плацебо (14 % и 5 %). На 3-й неделе эти цифры составили 40 % и 19 % соответственно. 42 % пациентов в группе арипипразола и 21 % в группе плацебо полностью закончили исследование. Ведущей причиной, приводящей к выбыванию, стала низкая эффективность и нежелательные явления: 22 % в группе арипипразола и 23% в группе плацебо. Экстрапирамидные симптомы в виде акатизии встречались в 11 % случаев, тремор — в 6% при приеме арипипразола, по 3 % каждого показателя при приеме плацебо. Изменение массы тела у пациентов в обеих группах было незначительным, и даже отмечались тенденции к её уменьшению. Уровень пролактина в крови был значительно ниже в группе пациентов, принимавших арипипразолол, чем в группе, принимавшей плацебо. Ни у одного из пациентов, получавших препарат, не были выявлены изменения в интервале QT по результатам в случайно отобранных ЭКГ.
Другая работа с похожим дизайном была проведена Sachs G. с соавт. в 2006 году. Лечение острых маниакальных или смешанных состояний у пациентов с биполярным расстройством первого типа: 3х недельное, мультицентровое, двойное слепое, рандомизированное, плацебо-контролируемом исследование. После рандомизации больные получали 30 мг арипипразола, который мог быть уменьшен до 15 мг для лучшей переносимости. В исследовании участвовало 272 пациента: 137 человек в группе арипипразола и 135 в группе плацебо. Закончили исследование 55 % пациентов в группе антипсихотика и 52 % в группе плацебо. Подобно первому двойному слепому исследованию Р. Keck с соавт. (2003), у пациентов, лечившихся арипипразолом, наблюдалось более выраженное улучшение на всех визитах, начиная с 4 го дня терапии. К 7-му дню количество респондеров на арипипразоле составило 37 %, плацебо — 27 %. К окончанию исследования (21й день) 53% респондеров было в группе антипсихотика и 32 % на плацебо. Необходимо отметить, что 38 человек из группы арипипразола и 27 человек в группе плацебо достигли критериев выздоровления уже на 2й неделе приема препарата и были выписаны из стационара, будучи переведенными на амбулаторное лечение. Главной причиной, по которой больные прекращали участие в исследовании, стал отзыв согласия (арипипразол п=35 (25%), плацебо n=25 (19%)). В то время как число пациентов, прекративших участие в исследовании из-за нежелательных явлений, был примерно одинаковым в двух группах (арипипразол n=12 (9%), плацебо n=10 (7 %)), но прекращение из-за низкой эффективности было в два раза меньше в группе арипипразола n=12 (9%), чем в группе плацебо n=28 (21 %) (р=0,004). Если сравнить подгруппы, где у пациентов было диагностировано биполярное расстройство с быстрой сменой фаз, арипипразол статистически достоверно снижал общий средний бал как по шкале YMRS: -15,27 (n=26), в группе плацебо — 5,45 (n=20), так и по шкале MADRS: — 4,81 (n=25) и -0,67 (n=19).
Так же арипипразол был эффективен и у группы пациентов со смешанным эпизодом: по шкале YMRS -14,12 (n=59), плацебо -9,02 (n=51). По шкале MADRS — 7,93 (n=59) и -4,29 (n=49). В проведенном исследовании не было выявлено существенных различий между группами арипипразола и плацебо в изменении среднего балла по шкалам SAS и AIMS. Самым встречающемся экстрапирамидным расстройством была акатизия, которая в 17,6% случаев встречалась в группе арипипразола и 4,5 % в группе плацебо. Однако акатизия редко приводила к прекращению лечения (2 %) или сокращению дозы (5%). Такие нежелательные явления, как головокружение, тошнота, диспепсия, запоры более часто встречались в группе арипипразола, чем в группе плацебо (>5% различия между группами), но они наблюдались в течение первой недели, и имело умеренную интенсивность. Во вторую и третью недели распространенность данных явлений в группе антипсихотика была подобна группе плацебо.
Изменение массы тела в данном исследовании были незначительными (<0,6 кг) и сопоставимо между двумя группами. Кроме того, только 1 человек, получающий арипипразол (0,7 %) и 5 в группе плацебо (3,8 %) испытали существенное увеличение веса (>7 % от начального). В этом 3-недельном исследовании арипипразол минимально влиял на повышение уровня в крови пролактина, глюкозы и холестерина, и был сопоставим с эффектом плацебо. Изменения в интервале QTc так же не были выявлены.
Интересные данные были получены Р. Keck с соавт. (2006) в 26 недельном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании пациентов с биполярным расстройством I типа. Оно было разбито на две фазы. Первая — стабилизационная (6-18 недель), где пациенты получали арипипразол в дозировках 15 или 30 мг. При достижении редукции баллов по шкалам YMRS и MADRS (YMRS<10, MADRS<13) наступала следующая фаза в виде двойного слепого назначения препарата (15 или 30 мг) или плацебо. 567 человек вошло в стабилизационный период исследования. Из них 361 (64%) выбыли на этой стадии из-за нежелательных явлений (22%), низкой эффективности (12%), отзыва согласия (12%), и только 206 пациентов (32%) завершили участие на этом отрезке. В следующую фазу был включен 161 пациент (28%), 67 (42%) из которых закончили его и 94 (58%) выбыли: низкая эффективность (арипипразол — 24%, плацебо — 43%). Из тех пациентов, кто был включен в стабилизационную, фазу только 12% закончили полностью исследование. Оценивая профилактическую эффективность арипипразола, необходимо отметить, что на протяжении 26-недельного лечения у 49 % пациентов, получавших плацебо, и 72%, принимавших антипсихотик, не наблюдалось рецидива маниакального состояния. Во время второй фазы в группе плацебо рецидив был отмечен у 43 % в группе плацебо и 25 % в группе арипипразола. Назначение арипипразола привело к значительно меньшему количеству эпизодов рецидива мании, чем плацебо (8 % и 23 %).
В течение второй фазы 58 (69,9 %) пациентов, получающих плацебо, и 57 (74 %) пациентов, принимающих арипипразол, пожаловались хотя бы на одно нежелательное явление. В группе арипипразола отмечались такие явления, как: тремор (9,1 %) акатизия (6,5%), вагинит (6,4 %) и боли в конечностях (5,2 %) встречались как минимум вдвое чаще, чем такие же нежелательные явления в группе плацебо. Шесть пациентов (7,4%) в группе плацебо и 7 пациентов (9,2%) в группе арипипразола имели общий бал по шкале SAS >15; 2 (2,5 %) и 4 (5,3 %) — общий бал по шкале Barnes >3. Кроме того, только 7 человек, получающих арипипразол (13%), испытали существенное увеличение веса (>7 % от начального). Изменения клинических лабораторных тестов были минимальны и сопоставимы с результатами группы плацебо.
Vieta E. et al., (2005) продемонстрировал эффективность арипи-празола по сравнению с галоперидолом в сравнительном, двойном слепом, рандомизированном, 12-недельном исследовании при острых маниакальных состояниях в рамках биполярного расстройства I типа. Первая фаза исследования (1-3 неделя): включались пациенты с суммарным баллом по шкале Young > 20, получавшие 15 мг/сут арипипразола или 10 мг/сут галоперидола. К концу 1-2 недели эти дозы могли быть увеличены до 30 мг и 15 мг соответственно. К концу Зй недели пациенты с общим количеством баллов для CGI-BP>4 и MADRS>18 — исключались из дальнейшего исследования. Вторая фаза (4-12 неделя): суточные дозы препаратов по необходимости могли быть уменьшены до 15 мг/сут для арипипразола и 10 мг/сут для галоперидола. Эффективность оценивалась 50% редукцией по шкале YMRS.
В исследовании приняло участие 347 пациента. 175 попало в группу арипипразола и 172 в группу галоперидола. Средний бал по шкале YMRS для арипипразола составил 31,1+0,5, для галоперидола — 31,5+0,6.На Зй неделе средняя суточная принимаемая пациентами доза препарата для арипипразола составило 22,6 мг, для галоперидола — 11,6 мг. К концу 12 недели — 21,6 мг и 11,1 мг соответственно. 229 человек (66%) закончили первую фазу исследования: 134 (76,6%) — арипипразол и 95 (55,2%) — галоперидол. Разница составила 21,3%. К концу второй фазы полностью завершили исследование 89 (50,9%) в группе арипипразола и 50 (29,1 %) в группе галоперидола с разницей в 21,8%. К концу первой фазы практически 51 % респондеров было в группе арипипразола и 42,6 % в группе галоперидола. Редукция по шкале YMRS в среднем составила -15,7 в обеих группах. К концу второй фазы количество респондеров в группах арипипразола и галоперидола составило 49,7 % и 28,4 % соответственно. Редукция по шкале YMRS -29 у арипипразола и -27,4 у галоперидола, по шкале CGI-BP -3,71 и — 3,55, по шкале MADRS -2,0 и -0,7.
В целом, 208 (59,9%) пациентов выбыло из 12-недельного исследования: галоперидол — 122 (70,9%), арипипразол 86 (49,1 %). Из них в первые 3 недели выбыло 118 пациентов (34,0%) (галоперидол — 77 (44,8%), арипипразол — 41 (23,4%)). Экстрапирамидная симптоматика чаще встречалась в группе пациентов, принимавших галоперидол (32 пациента (18,9 %) чем в группе арипипразола 5 (2,9 %)); акатизия — 2 (14,2 %), 9 (5,1 %) соответственно. Средние значения таких шкал, как SAS, BAS, AIMS во время лечения наиболее выражены были в группе галоперидола (SAS арипипразол 0,65, галоперидол 4,85; BAS 0,15 и 0,57; AIMS 0,04 и 0,5). В этом исследовании увеличение массы тела было минимальным для арипипразола (0,27 кг) и галоперидола (-0,1 кг). Повышение уровня пролактина в крови выше нормы в группе галоперидола было зафиксировано у 57,1 % пациентов, в группе арипипразола 14,1 % случаев. Анализируя изменения на электрокардиограмме, расширение комплекса QTc было зарегистрировано у 4 (2,7 %) пациентов в группе галоперидола и 5 (3%) в группе арипипразола.
Схожие результаты при изучении эффективности галоперидола и арипипразола были получены в 12-недельном, рандомизированном, плацебо контролируемом исследовании A. Young (2009). Группа арипипразола (n=167) получала препарат в дозе 15 мг/сут или 30 мг/сут, группа галоперидола (n=165) получала препарат в дозе от 5 до 15 мг/сут. На 21-й день терапии отмечалось снижение среднего балла по шкале YMRS в группе арипипразола -12,0, в группе ГАЛ -12,8, плацебо -9,7 (р<0,01), однако не было выявлено статистической достоверности по сравнению с плацебо по числу респондеров (47 % пациентов в группе арипипразола, 49,7 % — в группе галоперидола, 38,2 % — в группе плацебо) и пациентов, отвечающим критериям ремиссии (YMRS<12) (44% — в группе арипипразола, 45,3% — в группе галоперидола, 36,8% в группе плацебо). К 12-й недели терапии число респондеров выросло в группе арипипразола до 72,3 %, галоперидола — до 73,9 %, число пациентов, достигших критериев ремиссии до 69,9% и 73,9, соответственно. Экстрапирамидные побочные эффекты наблюдались чаще в группе галоперидола (53,3 %) по сравнению с группой арипипразола (23,5 %).
Были проведены работы, в которых показано успешное использование арипипразола в качестве аугментации монотерапии МС нормотимиками (литий, вальпроат натрия, ламотриджин). Результаты данных исследований свидетельствуют о снижени частоты рецидивов аффективных фаз хорошей переносимости лечения при добавлении арипипразола к нормотимику, при предшествующей неэффективности последнего в виде монотерапии (Vieta Е. 2008, 2010; Marcus R. 2011).
В исследованиях (Currier G., 2007; Zimbroff D., 2007) изучались возможности использования инъекционной формы препарата. Было показано, что у пациентов, получивших в/м инъекции АРП 9,75 мг (п=78), 15 мг (п=78), через 2 часа наблюдалась значительно более выраженная редукция психомоторного возбуждения, оцененная по шкале PANSS-EC, по сравнению с пациентами, получавшими плацебо (п=75). Переносимость внутримышечной формы АРП была сопоставима с пероральной формой препарата.
В настоящий момент обсуждается также вопрос об эффективности другого нового АА азенапина (в России не зарегистрирован) (Gonzalez J., 2011). Было проведено две работы (McIntyre R., 2010; Calabrese J., 2010), схожих по дизайну, по сравнению азенапина (АЗП) и оланзапина (ОЛЗ): 3-х недельное, двойное слепое, плацебо-контролируемое исследование при биполярном расстройстве I типа. Было включено 976 пациентов, которым назначался АЗП в гибкой дозе 5-10 мг/сутки дважды в день (п=379), ОЛЗ — 2-20 мг/сут (п=395). Оба исследования показали значительное снижение среднего балла по шкале YMRS, в двух исследованиях редукция составила -11 баллов у АЗП,-14 баллов у ОЛЗ,-7 баллов — у плацебо. Эффект ОЛЗ статистически превосходил эффект АЗП. Со 2-го дня терапии в группе азенапина и оланзапина отмечалось статистически значимое улучшение состояния больных по сравнению с группой плацебо. Редукция среднего балла шкалы MADRS статистически значима была только в группе ОЛЗ в обоих исследованиях. Количество респондеров в группе азенапина составила 42 %, критериям ремиссии соответствовало 36%, выбыло из исследования около 35 %. Пациентам, завершившим 3-х недельное исследование, было предложено продолжить участие в 9-недельном исследовании (McIntyre R., 2009). К концу 84 дня терапии редукция среднего балла шкалы YMRS составила -24,4 в группе азенапина и 23,9 — в группе оланзапина. Количество респондеров в группе азенапина увеличилось до 77 %, а критериям ремиссии соответствовало 75%. Редукция по шкале MADRS составила 2,6 балла у азенапина и 2,4 — у оланзапина. В продолженном 40-недельном исследовании (McIntyre R., 2010) количество респондеров и пациентов с критериями ремиссии увеличилось до 98 %, редукция по шкале MADRS составила 4,8 баллов, по шкале CGI-BP 3,2 балла. Из побочных эффектов наиболее часто встречались головная боль, сонливость, тошнота, паркинсонизм, тремор. Увеличение веса более чем на 7 % было отмечено у 39,2 % в группе азенапина и 55,1 % в группе оланзапина.
Несмотря на положительные предварительные результаты по оценке эффективности и переносимости азенапина и арипипразола при МС у больных БАР, определение их места в системе терапии нуждается в проведении дополнительных рандомизированных клинических исследований.
Интересная работа Cipriani А. (2011) была опубликована в журнале Lancet, где были проанализированы данные 68 рандомизированных, контролируемых исследований оценки эффективности препаратов для купирования острой мании с общим числом пациентов более 16000 человек (рис. 1).
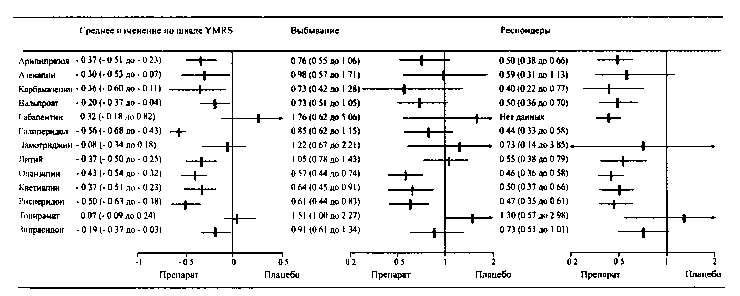
Рис. 1. Результаты мета-анализа РКИ по оценке эффективности лекарственной терапии при купировании острой мании
Оценка этих исследований состояла в изучении изменения среднего балла по шкале YMRS на протяжении 3-х недель, принимались также во внимание количество пациентов, завершивших исследования досрочно и количество респондеров. Так, галоперидол, оланзапин, кветиапин, зипрасидон, арипипразол, азенапин, вальпроат натрия, литий и карбамазепин были статистически достоверно эффективнее, чем плацебо. Такой достоверности не было обнаружено при использовании габапептина, ламотриджина и топирамата. По степени эффективности галоперидол, рисперидон и оланзапин превзошли другие препараты. Пациенты, которые принимали оланзапин, кветиапин и рисперидон, реже отказывались от лечения, чем те которые принимали галоперидол. Интересно, что антипсихотические препараты оказались более эффективными, чем нормотимики. Из всех антипсихотических препаратов, по профилям эффективности и комплаентности были установлены преимущества для рисперидона и оланзапина. Другие антипсихотические препараты (азенапин, зипрасидон), вальпроаты, литий показали меньшую эффективность и комплаентность, что предполагает их выбор менее очевидным для лечения острой мании. Ламотриджин, топирамат и габанептин не отличались существенно от плацебо с точки зрения эффективности и приемлемости.
Опубликованы также данные отечественных проспективных исследований. Так в открытом, рандомизированном, сравнительном исследовании, проведенном на базе отдела терапии психических расстройств НИИ психиатрии (А. А. Шафаренко, С. Н. Мосолов, 2011), было включено 129 пациентов с маниакальной симптоматикой в рамках шизоаффективного и биполярного расстройств, в возрасте от 18 до 65 лет и суммарным баллом по шкале YMRS >20. Пациенты были разделены на группы следующим образом: 22 человека получали монотерапию рисперидоном (РИС) в средней дозе 5,3±0,9 мг/сут, 23 — оланзапином (ОЛА) — 16,7±6,3 мг/сут, 21 — кветиапином (КВТ) — 638,1±135,9 мг/сут, 20 — зипрасидоном (ЗИП) -133± 16,3 мг/сут, 22 — галоперидолом (ГАЛ) — 22,3±5,9 мг/сут, 21 человек получал комбинированную терапию галоперидолом и литием (ГАЛ+ЛИТ) — 20,2±5,9 мг/сут и 733,3± 123,8 мг/сут течение б недель. Все группы были сопоставимы по основным клинико-демографическим показателям. Оценка клинической эффективности проводилась в 0, 4, 7, 14, 28 и 42 дни терапии с использованием шкалы YMRS, CGI, MADRS. Безопасность препаратов и побочные явления учитывались посредством регистрации всех неблагоприятных явлений, возникших в ходе исследования, а также с помощью шкалы Симпсона-Ангуса (SAS). Вторым критерием для оценки эффективности лечения было число пациентов, достигших ремиссии (YMRS<8, MADRS<8) на 6-й неделе терапии. Во всех терапевтических группах наблюдалась выраженная статистическая достоверная редукция симптоматики по шкале YMRS по сравнению с фоном (р<0,001). Процент редукции среднего балла по шкале YMRS составил 54,4 % в группе КВТ, по 53 % в группах ОЛЗ и ЗИП, 52,4% в группе РИС. Число респондеров (50 % редукция по шкале YMRS) к 42 дню в группе ЗИП составило 70 %, в группе КВТ — 66,7 %, в группе ОЛЗ — 65,2 %, в группе РИС -63,6%. Из-за низкой терапевтической эффективности и возникновения нежелательных явлений (НЯ) выбыло из исследования 31,8% — РИС, 30,4% — ОЛА, 28,6% — КВТ, 25% — ЗИП. В группах ОЛА и РИС преобладало повышение массы тела более чем на 7 % (21 % и 12 %). Важным вариантом оценки эффективности проводимой фармакотерапии является достижение ремиссии, с чем связывают более длительную стабильность состояния (снижение риска раннего рецидива), возвращение к прежнему уровню социальной адаптации и профессионального функционирования с сохранением высокого уровня качества жизни больных. Число больных, достигших критериев ремиссии, в группе кветиагшна составило 12 (57,1 %), галоперидол+литий — 11 (52,4%), оланзапина — 12 (52,2%), риспе-ридона — 9 (41 %), зипрасидона — 8 (40%), галоперидол — 3 (13,6%). Классический антиманиакальный нейролептик галоперидол, наряду с другими видами терапии, эффективно купировал маниакальную симптоматику, но обнаружил депрессогенное действие. При этом у двух пациентов в этой терапевтической группе была отмечена инверсия фазы. При оценке клинической эффективности по шкале МADRS средний балл в группе галоперидола увеличился на 9 % к 6-й неделе терапии.
Учитывая равные возможности в купировании острой маниакальной симптоматики всех изученных препаратов, мы сравнили их эффективность в зависимости от клинического варианта МС: эйфорический, дисфорический, МС со смешанными чертами. Анализируя терапевтический ответ исследуемых лекарственных средств, следует отметить, что количество респондеров при эйфорическом типе МС было значительным во всех группах. При дисфорическом типе МС наиболее эффективным оказался вальпроат натрия (57,1 % респондеров). В группах галоперидола, кветиапина и лития отмечалась наименьшая эффективность. Данные по группам рисперидона, оланзапина и зипрасидона требуют уточнения, так как было небольшое число наблюдений с гневливой манией. При МС со смешанными чертами наиболее эффективными были кветиапин и галоперидол+литий.
В другом открытом рандомизированном сравнительном исследовании монотерапии МС у больных БАР I оланзапином (средняя доза — 17,0±1,5 мг/сут), кветиапином (средняя доза -496±0,79 мг/сут) и рисперидоном (средняя доза — 5,4±0,79 мг/сут) на небольшой выборке больных (в группах было по 15 человек) не было установлено значимых различий между препаратами, хотя редукция симптоматики по шкале YMRS через 6 недель терапии была несколько большей в группе оланзапина (49,3%), чем в группе кветиапина (40%) и рисперидона (36%) (Кузавкова М. В., Беленькая Д. В., 2005).