Норадренергическая и серотонинергическая системы являются одними из главных нейромедиаторных систем мозга и участвуют в формировании чувств, мышления и поведения. Антидепрессанты обычно блокируют обратный захват норадреналина (НА), серотонина (СЕР) и реже дофамина (ДА) пресинаптическими окончаниями, что сопровождается немедленным увеличением концентрации этих нейромедиаторов в синаптической щели и усилением их воздействия на постсинаптический нейрон.
Ингибиторы моноаминооксидазы (ИМАО), также обнаружившие антидепрессивную активность, блокируют фермент, разрушающий НА, СЕР и ДА в пресинаптических нейронах, что тоже приводит к повышению содержания этих нейромедиаторов в в синаптической щели. Эти факторы послужили толчком для создания так называемой теории моноаминового дефицита в развитии депрессии, которая является основной до настоящего времени. Вместе с тем, многочисленные исследования с определением метаболитов НА, СЕРи ДА в плазме, моче, спинномозговой жидкости, а также посмертные исследования показали противоречивые результаты. Недавние исследования с применением позитронно-эмиссионной томографии (ПЭТ) и лиганда мозговой МАО показали 30%-ное увеличение активности фермента у больных РД (Meyer J. Н. et al., 2006).
Еще одним косвенным доказательством наличия дефицита СЕР в мозге при депрессиях являются данные, полученные в экспериментах с использованием диеты с низким содержанием аминокислоты триптофана, из которой в организме синтезируется СЕР. Такая безтриптофановая диета приводит к быстрому снижению триптофана в плазме и мозге и резкому замедлению синтеза СЕР. При этом у здоровых добровольцев депрессивная симптоматика не появляется, однако у больных депрессией с эффективным предшествующим лечением селективными ингибиторами обратного захвата серотонина (СИОЗС) наблюдается быстрый рецидив (Ruhe H.G. et al.,2007). Аналогичным образом альфа-метилпаратирозин, ингибирующий тирозингидроксилазу, важнейший фермент синтеза катехоламинов, не вызывает депрессии у здоровых лиц, но приводит к экзацербации депрессивной симптоматики у больных с хорошим эффектом ингибиторов реаптейка норадреналина (Ruhe Н. et al., 2007). Эти данные однозначно свидетельствуют в пользу наличия моноаминового дефицита при депрессиях и его коррекции с помощью антидепрессантов, однако несомненно также, что в этиопатогенезе депрессии участвуют и другие нейрохимические факторы.
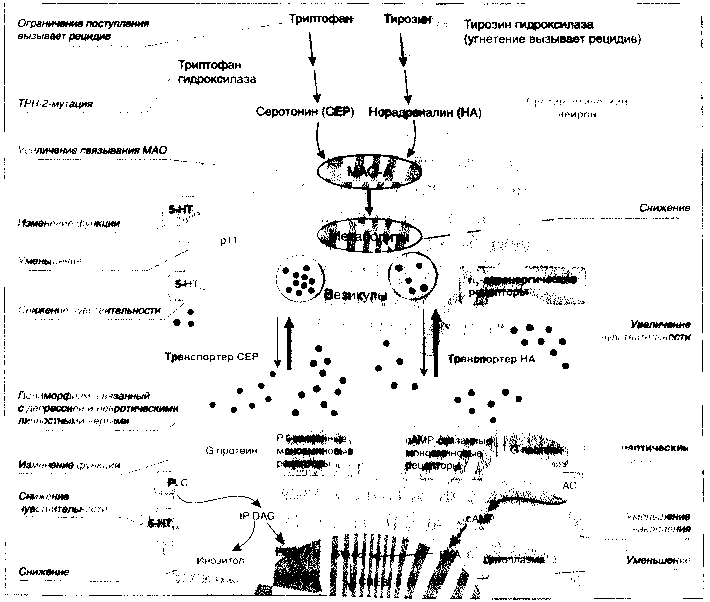
Поскольку прямое определение уровня моноаминовой нейропередачи в ЦНС невозможно, важное значение приобретают исследования, дающие косвенное представление об активности синаптической нейропередачи в серотонинергических и норадренергических путях (рис. 1).
5-НТ1В серотониновый рецептор располагается на пресинаптической мембране и регулирует высвобождение СЕР по типу обратной связи. Посмертные исследования содержания белка pH, усиливающего активность 5-НТ1B рецептора, показывают его снижение в мозге больных РД (Svennigsson Р. et al., 2006). 5-НТ1A рецепторы располагаются как на пре-, так и на постсинаптической мембране и являются одним из главных механизмов передачи импульса в серотонинергических путях. Чувствительность этих рецепторов снижена при депрессии (Pitchot W. et al., 2005). Альфа-2-норадренергические рецепторы располагаются преимущественно на пресинаптической мембране и регулируют высвобождение НА путем ингибирования обратной связи (рис. 1). При депрессии чувствительность этих рецепторов повышена, что сопровождается снижением высвобождения НА (Ozdway G. A. et al., 2003).
Интересна роль 2 типа С серотониновых рецепторов (5-НТ2С), которые широко представлены в лимбических структурах мозга, гиппокампе и лобной коре, а также в супрахиазматическом ядре (СХЯ) гипоталамуса, где они модифицируют реакцию нейронов на световые стимулы и принимают активное участие в регуляции ритмической организации сна (Kennaway O.J., Moyer R.W., 1998; Varcoe T.J, Kennaway D.J., 2008). Кроме того, эти рецепторы через вентротегментальное ядро оказывают опосредованное влияние на восходящую дофаминергическую трансмиссию (Alex К. О., Pehek Е. А., 2007; Luo A.N., Aston-Jones G., 2009), а через голубоватое пятно на норадренергическую трансмиссию. В этих ядрах, как и в лобной коре, возбуждающие 5-НТ2С рецепторы расположены на ГАМК-ергических интернейронах. Следовательно, блокада этих рецепторов стимулирует корковую дофаминергическую и норадренергическую нейропередачи, активность которых снижена при депрессии (Aloyo V. J. et al., 2009).
Примечание.
Моноаминовая гипотеза депрессии постулирует недостаточность серотонинергической и адренергической нейропередачи в ЦНС. Моноаминовая нейропередача реализуется в серотониновых и норадреналиновых синапсах, которые на рисунке для удобства изложения условно совмещены: справа представлена норадренегическая нейропередача, а слева — серотонинергическая. Серотонин синтезируется из триптофана каталитическим путем с помощью фермента триптофангидроксилазы, а норадреналин — из тирозина с помощью тирозин-гидроксилазы. Оба нейромедиатора накапливаются в везикулах пресинаптического нейрона и высвобождаются в синаптическую щель, воздействуя на рецепторы, расположенные как на постсинаптической, так и на пресинаптической мембранах. Прекращение нейромедиаторной передачи происходит 2 путями:
- с помощью сберегающего механизма обратного захвата нейромедиатора специфичным белком переносчиком (транспортером) с последующей аккумуляцией в везикулах пресинаптического нейрона и
- по механизму обратной связи посредством прекращения высвобождения нейромедиаторов через воздействие на регулирующие пресинаптические 5-НТ1А и 5-НТ1В-ауторецепторы в случае серотонинергической передачи и на а2-норадренергические ауторецепторы в случае норадренергической передачи. Моноаминооксидаза типа А (МАО-А) разрушает моноамины на пресинаптическом уровне и тем самым регулирует накопление нейромедиатора в везикулах. Протеин pH, взаимодействуя с 5-НТ1В-рецепторами, усиливает их функцию. На постсинаптической мембране СЕР или НА связываются гуаниннуклеотидтрифосфат связывающим протеином (G протеин), сцепленным с 2 типами рецепторов:
- циклическим аденозинмонофосфатом (сАМР), который активирует аденилатциклазу (АС) и запускает синтез сАМР, и
- фосфатидилинозитолом (PI), который активирует фосфолипазу Ц (PLC). PLC запускает синтез инозитола трифосфата (IP3) и диацилглицерола (DAG); сАМР активирует протеинкиназу А (РКА), a IP3 и DAG активируют протеинкиназу Ц (РКС).
Оба протеина воздействуют на сАМР эффект элемент -связывающий протеин (CREB). Исследования, поддерживающие гипотезу моноаминового дефицита при депрессиях, включают:
- развитие быстрого рецидива депрессивной симптоматики у больных с эффектом СИОЗС при ограничении потребления с пищей аминокислоты триптофана или ингибировании тирозингидроксилазы;
- увеличение частоты мутаций гена, связанного с выработкой мозговой формы триптофангидроксилазы (ТРН-2);
- усиление связывания специфичного лиганда с МАО-А;
- снижение чувствительности 5-НТ1А-рецепторов;
- нарушение функции 5-НТ1А-рецепторов;
- нарушение функции 5 НТ1В-рецепторов;
- снижение содержания p1 1;
- полиморфизм гена транспортера СЕР, связанный с развитием депрессии;
- неадекватную реакцию G-протеинов в ответ на нейромедиаторную стимуляцию;
- снижение содержания сАМР, инозитола и CREB в мозге больных депрессией в постмортальных исследованиях.
Тимоаналептический эффект большинства антидепрессантов развивается постепенно, не ранее, чем через 2-3 недели непрерывного приема препарата. Считается, что это связано с феноменом «down regulation» постсинаптических серотониновых рецепторов и, в частности, с постепенным преодолением наблюдающегося при депрессии парадоксального снижения серотонинергической трансмиссии вследствие угнетения 5-НТ2А-рецепторов. Поэтому десенситизация (повышение чувствительности) этих рецепторов имеет важное значение для развития клинического эффекта (Rausch J.L. et al., 2006). Один их новых антидепрессантов, недавно зарегистрированных в США, вилазодон обладает такими свойствами и, по предварительным данным, оказывает более быстрое действие, уже через неделю терапии (Rickels К. et al., 2009). Вместе с тем, клиническое изучение других препаратов (флибансерин, гепирон и др.) с агонистической активностью в отношении 5-НТ1А-рецепторов обнаружило противоречивые результаты (NuttD., 2008; Rizvi S.J., Kennedy S. V., 2011). Новые препараты, блокирующие обратный захват СЕР или НА и являющиеся агонистами 5-НТ1А-рецепторов, находятся в исследовании (Adell А., 2010; Petterson et al., 2011).
Система вторичных мессенджеров (внутриклеточная нейропередача) в моноаминовых системах также нарушена при депрессии. В постмортальных исследованиях мозга лиц, погибших вследствие суицидов, и при помощи магнито-резонансной спектроскопии (МРС) у больных депрессией было обнаружено снижение содержания инозитола в лобной коре (Simon Н. et al., 1997; Coupland N.J. et al., 2005). Снижение активности аденилатциклазы в ответ на бета-адренергическую стимуляцию наблюдалось в мозге больных депрессией, покончивших жизнь самоубийством (Valdizan Е. М. et al., 2003). Эти факты свидетельствуют в пользу нарушения внутриклеточной передачи импульса при депрессиях независимо от уровня содержания моноаминов в синаптической щели или числа рецепторов. При депрессиях меняется также активность G-протеина, который отвечает за передачу сигнала между рецепторами и системой вторичных мессенджеров (Avissar S. et al., 1997). Исследование роли G-протеинов в развитии депрессии затруднено, поскольку существуют несколько форм этого белка, присутствующих в различных структурах мозга. Во многих исследованиях показано, что длительное лечение антидепрессантами стимулирует функцию белка CREB (cyclic AMP response element-binding), являющимся транскрипционным фактором, контролируемым циклическим аденозинмонофосфатом (ЦАМФ) в клетке (Blendy J.A., 2006). Содержание CREB было снижено при посмертном изучении мозга больных РД, которые не принимали антидепрессантов (Blendy J. А., 2006).
В настоящее время не существует полностью адекватных животных моделей депрессии, особенно отражающих спонтанное развитие повторных фаз. Одной из новых экспериментальных моделей является блокирование («knockout») у животных определенных генов. В частности, при блокировании гена белка транспортера СЕР мыши становятся чрезмерно беспокойными, и у них чаще развивается реакция иммобилизации в плавательном тесте (Ansorge М. Z. et al., 2004). Это близко к тому, что наблюдается при полиморфизме гена у людей с невротическими личностными чертами (Lesch К. Р. et al., 1996), но прямо противоположно ожидаемому эффекту СИОЗС. Такую диспропорцию, по-видимому, можно объяснить существенной разницей между хронической моноаминовой недостаточностью, сформированной в период развития мозга, и гипотетическим острым снижением уровня моноаминов при депрессии у взрослых.
Косвенно гипотезу моноаминового дефецита при депрессии поддерживает быстрый эффект психостимулирующих средств. Например, кокаин и амфетамины являются мощными активаторами выброса моноаминовых нейромедиаторов в синаптическую щель. Известна также их способность блокировать механизм обратного захвата моноаминов. Эти средства оказывают немедленный эйфоризирующий и психостимулирующий эффекты, однако при тяжелых депрессиях часто происходит не ослабление собственно депрессивных симптомов, а развитие возбуждения. Некоторые исследования продемонстрировали, что немедленная клиническая реакция на однократное введение амфетамина коррелирует с курсовой эффективностью последующего курса СИОЗС (Tremblay L. К. et al., 2002).
Возможно, что в патогенезе депрессии определенную роль играет также центральная дофаминергическая недостаточность. Показано, что такие ядерные симптомы депрессии, как психомоторная заторможенность и ангедония, отчасти связаны со снижением дофаминергической активности в чечевидном ядре (Hasler G. et al., 2008) и феноменологически напоминают акинезию при паркинсонизме, в том числе вызванном нейролептиками. Кроме того, это подтверждается высокой распространенностью депрессии при болезни Паркинсона, депрессогенным эффектом резерпина, а также эффективностью известного антидепрессанта — бупропиона, обладающего вторичными дофаминергическими эффектами (ElMansuzi М. et al, 2008). Показана также эффективность при заторможенных депрессиях психостимуляторов метилфенидата и модафенила, а также прамипексола, прямого агониста дофаминовых рецепторов, который первично был разработан для лечения болезни Паркинсона (Gershon A. A. et al., 2007; Candy М. et al., 2008).
Следует отметить множественные морфологические и функциональные связи между тремя моноаминовыми нейромедиаторными системами, поэтому воздействие на одну систему косвенно всегда отражается на других (Arencibia-Albite F. et al., 2007; Guiard P. et al., 2008). В настоящее время в качестве антидепрессантов изучается несколько препаратов, одновременно блокирующих механизм обратного захвата всех трех моноаминов (Prins J. et al., 2010).
Основным клиническим доказательством существования моноаминового дефицита при депрессиях является высокая эффективность большинства современных антидепрессантов. Вместе с тем, около 30 % пациентов остаются резистентными к тимоаналептической терапии, и около 40-50 % больных реагируют на плацебо. Поэтому логично предположить, что моноаминовая недостаточность объясняет лишь часть случаев РД.