ФУНКЦИИ СИСТЕМЫ КРОВИ
Система крови включает:
- органы и ткани кроветворения, или гемопоэза, в которых созревают форменные элементы крови;
- периферическую кровь, которая включает циркулирующую и депонированную в органах и тканях фракции;
- органы кроворазрушения;
Система крови является внутренней средой организма и одной из его интегрирующих систем. Кровь выполняет многочисленные функции — дыхания, обмена веществ, экскреции, терморегуляции, поддержания водно-электролитного баланса. Она осуществляет защитные и регуляторные функции благодаря наличию в ней фагоцитов, различных антител, биологически активных веществ, гормонов. На процессы кроветворения влияют многие факторы. Важное значение имеют особые вещества, регулирующие пролиферацию и созревание клеток крови, — гемопоэтины, но общее регулирующее влияние оказывает нервная система. Все многочисленные функции крови направлены на поддержание гомеостаза.
Картина периферической крови и костного мозга позволяет судить о функциях многих систем организма. При этом наиболее полное представление о состоянии самой кроветворной системы можно получить, лишь исследуя костный мозг. Для этого специальной иглой (трепаном) проводят пункцию грудины или гребня подвздошной кости и получают костномозговую ткань, которую затем исследуют под микроскопом.
МОРФОЛОГИЯ КРОВЕТВОРЕНИЯ
Все форменные элементы крови в нормальных условиях образуются в красном костном мозге плоских костей — грудины, ребер, костей таза, позвонков. В трубчатых костях взрослого человека костный мозг представлен в основном жировой тканью и имеет желтый цвет. У детей в трубчатых костях происходит кроветворение, поэтому костный мозг красный.
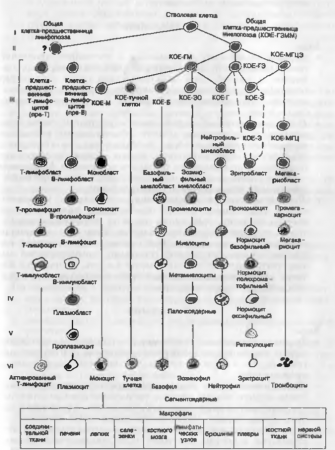
Морфогенез кроветворения.
Родоначальником всех клеток крови является стволовая кроветворная клетка костного мозга, которая трансформируется в клетки-предшественники, морфологически неотличимые друг от друга, но дающие начало миело- и лим-фопоэзу (рис. 42). Эти процессы регулируются гемопоэтинами, среди которых выделяют эритро-, лейко- и тромбоцитопоэтины. В зависимости от преобладания тех или иных поэтинов усиливается миелопоэз и клетки-предшественники начинают трансформироваться в бластные формы миелоцитарного, эритроцитарного и тромбоцитарного ростков крови. При стимуляции лимфопоэза начинается созревание лимфоцитарного, а также моноцитарного ростков крови. Таким образом происходит развитие зрелых клеточных форм — Т- и В-лимфоцитов, моноцитов, базофилов, эозинофилов, нейтрофилов, эритроцитов и тромбоцитов.
На разных этапах гемопоэза в результате патологических воздействий могут возникать нарушения созревания кроветворных клеток и развиваются болезни крови. Кроме того, на многие патологические процессы, возникающие в организме, система крови реагирует изменением своего клеточного состава и других параметров.
НАРУШЕНИЯ ОБЪЕМА ЦИРКУЛИРУЮЩЕЙ КРОВИ
При различных болезнях и патологических процессах может меняться общий объем крови, а также соотношение ее форменных элементов и плазмы. Выделяют 2 основные группы нарушений объема крови:
- гиперволемии — состояния, характеризующиеся увеличением общего объема крови и. обычно, изменением гематокрита;
- гиповолемии — состояния, характеризующиеся уменьшением общего объема крови и сочетающегося со снижением или увеличением гематокрита.
ГИПЕРВОЛЕМИИ
Виды:
- Нормоцитемическая гиперволемия — состояние, проявляющееся эквивалентным увеличением объема форменных элементов и жидкой части циркулирующей крови. Гематокрит остается в пределах нормы. Такое состояние возникает, например. при переливании большого количества (не менее 2 л) крови.
- Олигоцитемическая гиперволемия — состояние, характеризующееся увеличением общего объема крови вследствие возрастания главным образом объема плазмы. Показатель гематокрита при этом ниже нормы. Такая гиперволемия появляется при введении большого количества физиологического раствора или кровезаменителей, а также при недостаточности выделительной функции почек.
- Полицитемическая гиперволемия — состояние, проявляющееся увеличением общего объема крови вследствие преимущественного повышения числа ее форменных элементов, в первую очередь эритроцитов. При этом гематокрит становится выше нормы. Наиболее часто такое явление наблюдается при длительной гипоксии, стимулирующей выход эритроцитов из костного мозга в кровь, например у жителей высокогорья, на определенных этапах патогенеза ряда заболеваний легких и сердца.
ГИПОВОЛЕМИИ
Виды:
- Нормоцитемическая гиповолемия — состояние, проявляющееся уменьшением общего объема крови при сохранении гематокрита в пределах нормы, что наблюдается сразу после кровопотери.
- Олигоцитемическая гиповолемия характеризуется уменьшением общего объема крови с преимущественным снижением количества ее форменных элементов. Гематокрит при этом ниже нормы. Наблюдается также после кровопотери, но в более поздние сроки, когда из межклеточного пространства в сосуды поступает тканевая жидкость. В этом случае объем циркулирующей крови начинает возрастать, а количество эритроцитов остается на низком уровне.
- Полицитемическая гиповолемия — состояние, при котором снижение общего объема крови обусловлено в основном уменьшением объема плазмы. Показатель гематокрита при этом выше нормы. Такое сгущение крови наблюдается при потере жидкости после обширных ожогов, при гипертермии с массивным потоотделением, холере, характеризующейся неукротимой рвотой и поносом. Сгущение крови способствует также образованию тромбов, а уменьшение общего объема крови нередко приводит к сердечной недостаточности.
ПАТОЛОГИЯ СИСТЕМЫ ЭРИТРОЦИТОВ
Анемия, или малокровие, — снижение общего количества гемоглобина в организме и, как правило, гематокрита. В большинстве случаев анемии сопровождаются эритропенией — снижением количества эритроцитов в единице объема крови ниже нормы (менее 3 • 109/л у женщин и 4 • 109/л у мужчин). Исключением являются железодефицитная анемия и талассемия, при которых количество эритроцитов может быть нормальным или даже увеличенным.
Значение анемии для организма определяется прежде всего уменьшением кислородной емкости крови и развитием гипоксии, с которой связаны основные симптомы расстройств жизнедеятельности этих больных.
Виды анемий:
- вследствие кровопотери — постгеморрагические;
- вследствие нарушенного кровообразования — дефицитные;
- вследствие повышенного кроворазрушения — гемолитические.
По течению анемии могут быть острыми и хроническими.
По изменениям структуры эритроцитов при анемиях выделяют:
- анизоцитоз, который характеризуется разной формой эритроцитов;
- пойкилоцитоз — характеризуется разными размерами эритроцитов.
При анемиях изменяется цветной показатель — содержание гемоглобина в эритроцитах, который в норме равен I. При анемиях он может быть:
- больше 1 (гиперхромная анемия);
- меньше 1 (гипохромная анемия).
АНЕМИИ ВСЛЕДСТВИЕ КРОВОПОТЕРИ (ПОСТГЕМОРРАГИЧЕСКИЕ)
Эти анемии всегда вторичны, так как возникают в результате болезней или ранений.
Острая постгеморрагическая анемия возникает при острой кровопотере. например из сосудов дна язвы желудка, при разрыве маточной трубы в случае трубной беременности, из легочных каверн при туберкулезе и т. п. (внутреннее кровотечение) или из поврежденных сосудов при ранениях конечностей, шеи и других частей тела (наружное кровотечение).
Механизмы развития острых постгеморрагических состояний. На начальном этапе кровопотери в большей или меньшей мере снижается объем циркулирующей крови и развивается гиповолемия. В связи с этим уменьшается приток венозной крови к сердцу. его ударный и минутный выброс. Это обусловливает падение уровня артериального давления и ослабление сердечной деятельности. В результате уменьшается транспорт кислорода и субстратов метаболизма из крови к клеткам, а от последних — углекислого газа и отработанных продуктов обмена веществ. Развивается гипоксия, которая во многом определяет исход кровопотери. Крайняя степень указанных расстройств в организме обозначается как постгеморратический шок.
Морфология.
Проявлениями острой анемии являются бледность кожных покровов и малокровие внутренних органов. В связи с резким уменьшением оксигенации тканей повышается выработка эритропоэтина, стимулирующего эритропоэз. В костном мозге при этом происходит значительное увеличение числа клеток эритроидного ряда и костный мозг приобретает малиновый цвет. В селезенке, лимфатических узлах, периваскулярной ткани появляются очаги внекостномозгового, или экстрамедуллярного, кроветворения. Нормализация показателей периферической крови после восполнения кровопотери наступает примерно через 48—72 ч.
Нарушение гемодинамики и снижение интенсивности биологического окисления в клетках обусловливают включение адаптивных механизмов:
- активацию тромбообразования;
- реакции сердечно-сосудистой компенсации кровопотери в виде сужения просвета мелких сосудов и выброса крови из депо;
- повышение сердечного выброса;
- поддержание объема циркулирующей крови за счет поступления в сосуды жидкости из интерстиция.
Хроническая постгеморрагическая анемия возникает при значительной кровопотере вследствие повторяющихся кровотечений, например из геморроидальных вен, при маточных кровотечениях и т. п. Такая кровопотеря приводит к хронической гипоксии тканей и нарушению в них обмена веществ.
Морфология.
Хроническая гипоксия способствует развитию жировой дистрофии паренхиматозных органов. Желтый костный мозг трансформируется в красный, так как усиливаются эритро-и миелопоэз. В печени, селезенке, лимфатических узлах могут появляться очаги экстрамедуллярного кроветворения. Вместе с тем при длительно повторяющихся и выраженных ковопотерях может наступить гипо- и аплазия кроветворной ткани, что указывает на истощение гемопоэза.
АНЕМИИ ВСЛЕДСТВИЕ НАРУШЕННОГО КРОВООБРАЗОВАНИЯ (ДЕФИЦИТНЫЕ)
Эти анемии являются следствием недостатка ряда веществ, необходимых для нормального гемопоэза — железа, витамина B12, фолиевой кислоты и др. Среди них наибольшее значение имеет злокачественная анемия Аддисона—Бирмера. в основе которой лежит дефицит витамина В12 и фолиевой кислоты.
В12-дефицитная, или фолиеводефицитная, анемия. Этиология анемии связана с дефицитом витамина В12 и фолиевой кислоты, которая регулирует нормальный гемопоэз в костном мозге. Однако для активации фолиевой кислоты необходимо, чтобы поступающий с пищей витамин В12 (внешний фактор) соединился с образующимся в желудке белком — гастромукопротеином (внутренний фактор),который вырабатывается добавочными клетками желез слизистой оболочки желудка. Вместе они образуют комплекс, который называется антианемическим фактором. Затем этот комплекс поступает в печень и активирует фолиевую кислоту, а та в свою очередь стимулирует эритропоэз по эритробластическому типу. Если же развивается аутоиммунный гастрит и появляются антитела к добавочным клеткам или гастромукопротеину, которые уничтожают эти клетки или внутренний фактор, то в слизистой оболочке желудка не всасывается витамин В12 и не образуется гастромукопротеин. Такая же ситуация возникает при высокой резекции желудка по поводу опухоли или язвенного процесса.
Патогенез.
В результате атрофии слизистой оболочки желудка аутоиммунного характера возникает дефицит фолиевой кислоты и витамина В12. Нарушается эритропоэз и вместо эритроцитов образуются их предшественники — крупные мегалобласты, которые появляются в периферической крови. Однако мегалобласты быстро разрушаются, развиваются анемия и общий гемосидероз. Кроме того, при дефиците витамина В12 нарушается образование миелина в оболочках нервных стволов, что нарушает их функцию.
Патологическая анатомия.
У больных отмечаются бледность кожных покровов, водянистая кровь, точечные кровоизлияния, из-за атрофии слизистой оболочки языка он приобретает малиновую окраску (гунтеровский глоссит),характерны атрофический гастрит, уплотнение и увеличение печени из-за жировой дистрофии и гемосидероза, связанных с гипоксией и с усиленным разрушением мегалобластов. В спинном мозге — распад осевых цилиндров в задних и боковых столбах и очаги размягчения ткани мозга (фуникулярный миелоз),что сопровождается тяжелой неврологической симптоматикой. Костный мозг плоских и трубчатых костей красный, напоминает малиновое желе. В селезенке и лимфатических узлах очаги экстрамедуллярного кроветворения.
Течение заболевания прогрессирующее, с периодами ремиссии и обострения. Лечение анемии препаратами фолиевой кислоты и витамина B12 привело к тому, что больные перестали умирать от этого заболевания.
АНЕМИИ ВСЛЕДСТВИЕ ПОВЫШЕННОГО КРОВОРАЗРУШЕНИЯ — ГЕМОЛИТИЧЕСКИЕ
Для этих анемий характерно преобладание процесса разрушения эритроцитов (гемолиз) над их образованием. Продолжительность жизни эритроцитов при этом снижена и не превышает 90— 100 дней.
Виды гемолитических анемий
По происхождению гемолитические анемии делят на приобретенные (вторичные) и врожденные или наследственные.
Приобретенные гемолитические анемии могут быть вызваны многочисленными факторами. Этиология этих анемий связана с действием факторов физического, химического и биологического, в том числе аутоиммунного, характера, особенно при дефиците веществ, стабилизирующих мембраны эритроцитов, например а-токоферола. Наибольшее значение имеют так называемые гемолитические яды химического (соединения мышьяка, свинца, фосфора и др.) и биологического происхождения. Среди последних — яды грибов, различные токсичные вещества, образующиеся в организме при тяжелых ожогах, инфекционные болезни (например, малярия, возвратный тиф), переливание крови, несовместимой по группе или резус-фактору.
Патогенез.
Гемолиз эритроцитов может происходить внутри сосудов и за их пределами. При этом распадается гемоглобин и из гема синтезируются два пигмента — гемосидерин и билирубин. Поэтому гемолитические анемии обычно сопровождаются развитием общего гемосидероза и желтухи. Кроме того, эритропения и распад гемоглобина приводят к появлению выраженной гипоксии, сопровождающейся жировой дистрофией паренхиматозных органов.
Морфология гемолитических анемий характеризуется развитием гиперпластических процессов в костном мозге, в связи с чем он приобретает малиновый цвет, появлением очагов экстрамедуллярного кроветворения, выраженной желтухой кожных покровов и внутренних органов, гемосидерозом и жировой дистрофией печени, сердца и почек.
Гемолитическая болезнь новорожденных является примером приобретенных гемолитических анемий и имеет большое значение в акушерской и педиатрической практике. В ее основе лежит иммунный конфликт между матерью и плодом по резус-фактору, который обладает антигенными свойствами. Этот фактор впервые был обнаружен в эритроцитах обезьян макак резусов и имеется у 80—85% людей. Если мать резус-отрицательна, т. е. не имеет резус-фактора, а плод резус-положительный, то в организме матери образуются антитела против эритроцитов плода и у него возникает внутрисосудистый гемолиз эритроцитов.
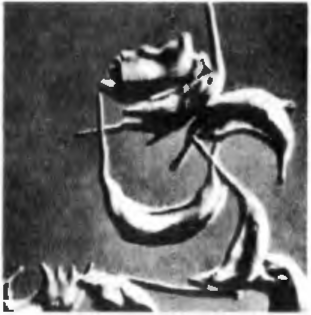
Рис. 43. Серповидно-клеточная анемия. Эритроциты серповидной формы. Электронограмма.
При этом плод может погибнуть на 5—7-м месяце беременности, а у новорожденных развивается гемолитическая анемия, сопровождающаяся малокровием и жировой дистрофией внутренних органов, выраженной желтухой и гемосидерозом.
Наследственные, или врожденные, гемолитические анемии связаны с каким-либо генетическим дефектом структуры мембран, ферментов или гемоглобина. Этот дефект передается по наследству.
Виды: врожденные гемолитические анемии в зависимости от генетического дефекта могут быть обусловлены мембранопатиями, ферментопатиями, гемоглобинопатиями.
Патогенез всех врожденных гемолитических анемий в основном сходен — в результате того или иного генетического дефекта либо разрушается мембрана эритроцитов, а сами эритроциты уменьшаются в размерах и могут принимать сферическую форму (микросфероцитоз), либо повышается проницаемость мембраны и эритроциты увеличиваются в размерах за счет поступления избыточного количества жидкости, либо нарушается синтез гемоглобина (гемоглобинозы) и образуются эритроциты неправильной формы, содержащие быстро распадающийся гемоглобин, причем удерживающий кислород (талассемия, серповидно-клеточная анемия и др.) (рис. 43).
Морфология врожденных гемолитических анемий мало отличается от изменений при вторичных гемолитических анемиях, за исключением размеров и формы эритроцитов. Также характерны выраженный внутрисосудистый гемолиз, гипоксия, гемосидероз, жировая дистрофия паренхиматозных органов, гиперплазия кроветворной ткани, возможны очаги экстрамедуллярного кроветворения, гепато- и спленомегалия.
ПАТОЛОГИЯ СИСТЕМЫ ЛЕЙКОЦИТОВ
В крови здорового человека в условиях покоя натощак содержится 4 • 109/л лейкоцитов. Много лейкоцитов находится в тканях, где они участвуют в иммунном контроле.
Типовые изменения количества лейкоцитов в единице объема крови характеризуются либо их снижением — лейкопении, либо увеличением — лейкоцитозы, что, как правило, является реакцией системы лейкоцитов, развивающейся при болезнях и патологических состояниях. Поэтому излечение болезни приводит к нормализации лейкоцитарной формулы.
Лейкопения — уменьшение количества лейкоцитов в единице объема крови ниже нормы, обычно менее 4 • 109/л. Она возникает в результате угнетения белого ростка системы гемопоэза, при усиленном разрушении лейкоцитов или при перераспределении крови между кровеносным руслом и депо крови, что наблюдается, например, при шоке.
Значение лейкопении заключается в ослаблении защитных сил организма и повышении его восприимчивости к различным инфекционным возбудителям.
Виды лейкопений по происхождению:
- первичные лейкопении (врожденные или наследственные) связаны с различными генетическими дефектами в системе кроветворения на разных этапах лейкопоэза;
- вторичные лейкопении возникают при действии на организм различных факторов — физических (ионизирующие излучения и т. п.), химических (бензол, инсектициды, цитостатики, сульфаниламиды, барбитураты и др.), продуктов метаболизма или компонентов различных возбудителей болезней.
Лейкоцитарная формула — соотношение различных видов циркулирующих лейкоцитов.
Если увеличивается количество молодых форм нейтрофилов (палочкоядерных, метамиелоцитов, миелоцитов, промиелоцитов), расположенных в левой части лейкоцитарной формулы, говорят о сдвиге формулы влево, что указывает на усиление пролиферации клеток миелоцитарного ряда. В правой части формулы располагаются зрелые формы этих клеток. Излечение болезни приводит к нормализации лейкоцитарной формулы. Уменьшение нормального числа лейкоцитов в лейкоцитарной формуле указывает на снижение регенераторных возможностей миелоидной ткани.
Патогенез лейкопений отражает нарушение или угнетение процесса лейкопоэза, а также чрезмерное разрушение лейкоцитов в циркулирующей крови или в органах гемопоэза, перераспределение лейкоцитов в сосудистом русле, возможна также потеря лейкоцитов организмом. При этом вследствие угнетения регенерации лейкопоэтической ткани на начальных этапах лейкопении снижается количество молодых форм нейтрофилов, а увеличение их молодых форм (т. е. сдвиг лейкоцитарной формулы влево) указывает на прекращение повреждающего действия и активацию лейкопоэза. Возможно также появление анизоцитоза и пойкилоцитоза лейкоцитов.
Лейкоцитоз — увеличение количества лейкоцитов в единице объема крови выше 4 • 109/л. Он может быть физиологическим, адаптивным, патологическим или носить форму пейкемоидной реакции.
- Физиологический лейкоцитоз возникает у здоровых людей в связи с перераспределением крови во время пищеварения, при физической работе.
- Адаптивный лейкоцитоз развивается при заболеваниях, особенно характеризующихся воспалением. При этом количество лейкоцитов может увеличиваться до 40 • 109/л.
- Патологический лейкоцитоз отражает опухолевую природу лейкоцитоза и характеризует лейкоз.
Лейкемоидная реакция — повышение общего чиста лейкоцитов периферической крови более 40 • 109/л с появлением их незрелых форм (промиелоцитов, миелобластов), что делает лейкоцитоз похожим на лейкоз.
Виды лейкоцитоза связаны с увеличением тех или иных форм лейкоцитов:
- базофильный — увеличение количества базофилов, встречается редко, в основном при некоторых лейкозах;
- эозинофильный — проявляется увеличением количества эозинофилов и характерен для хронического воспаления, заболеваний, вызванных паразитами (аскаридоз, эхинококкоз, трихинеллез и т. п.), а также как проявление аллергии (бронхиальная астма);
- нейтрофильный — наиболее частый вид лейкоцитоза. Характерен для гнойного и других видов экссудативного воспаления, а также для асептического воспаления (например, инфаркт миокарда), развивается при кровопотере и др. При этом обычно наблюдается сдвиг лейкоцитарной формулы влево;
- лимфоцитарный — развивается при некоторых хронических инфекционных заболеваниях, таких как туберкулез, бруцеллез и др., а также может быть в норме у детей раннего возраста;
- моноцитарный — появляется при некоторых протозойных (малярия, лейшманиоз) и вирусных инфекциях (инфекционный мононуклеоз, краснуха).
Агранулоцитоз — отсутствие или значительное снижение абсолютного числа всех видов зернистых гранулоцитов (лейкоцитов) — нейтрофилов, эозинофилов, базофилов. Агранулоцитоз, как правило, сочетается с лейкопенией.
ОПУХОЛИ СИСТЕМЫ КРОВИ, ИЛИ ГЕМОБЛАСТОЗЫ
Гемобластозы — опухолевые заболевания кроветворной и лимфатической ткани. Они подразделяются на системные заболевания — лейкозы, и регионарные — злокачественные лимфомы, или гематосаркомы. При лейкозах первично поражается костный мозг и опухолевые клетки обнаруживаются в крови (лейкемия), а при лимфомах в терминальной стадии наступает обширное метастазирование со вторичным поражением костного мозга. По распространенности гемобластозы занимают 5-е место среди всех опухолей человека. У детей первых 5 лет жизни на их долю приходится 30 % случаев онкологических заболеваний.
Этиология гемобластом принципиально не отличается от причин, вызывающих другие опухоли (см. главу 10) — это различные мутагенные факторы экзо- и эндогенного происхождения, действующие на стволовые и полустволовые клетки-предшественницы. Большое значение в возникновении гемобластозов имеет наследственный фактор.
Патогенез.
Множество этиологических факторов воздействуют на геном стволовых и полустволовых клеток, приводя к их злокачественной трансформации. Поэтому геном является так называемым узким местом, через которое мутагены воздействуют на протоонкогены и антионкогены, превращая их в клеточные онкогены, что приводит к появлению опухоли. Развитие гемобластозов начинается с малигнизации одной стволовой или полустволовой клетки, дающей пул опухолевых клеток. Следовательно, все гемобластозы имеют моноклоновое происхождение, и все последующие опухолевые клетки развиваются из первоначально мутировавшей клетки и относятся к одному клону. Кроме малигнизации на уровне стволовых и полустволовых клеток-предшествен-ниц, развивается еще блок дифференцировки в пуле опухолевых клеток и они теряют способность к созреванию.
ЛЕЙКОЗЫ
Лейкозы — системные опухолевые заболевания, возникающие из кроветворных клеток с поражением костного мозга.
Заболеваемость лейкозами колеблется от 3 до 10 на 100 000 населения. Мужчины болеют в 1,5 раза чаще женщин. Острые лейкозы чаще наблюдаются в возрасте от 10 до 18 лет, а хронические — у людей старше 40 лет.
Морфогенез.
При лейкозах опухолевая ткань первоначально разрастается на территории костного мозга и постепенно подавляет и вытесняет нормальные ростки кроветворения. Поэтому у больных лейкозом развиваются анемия, тромбоците-, лимфоците-, гранулоцитопения, что приводит к повышенной кровоточивости, кровоизлияниям, снижению иммунитета и присоединением инфекционных заболеваний. Метастазирование при лейкозах заключается в появлении лейкозных инфильтратов в печени, селезенке, лимфатических узлах, стенках сосудов и др. Обтурация сосудов опухолевыми клетками приводит к развитию инфарктов органов и язвенно-некротическим осложнениям.
Классификация лейкозов основана на 5 признаках этих заболеваний.
- По степени дифференцировки опухолевых клеток выделяют недифференцированные, властные и цитарные лейкозы. При высоком уровне блока дифференцировки клетки опухоли напоминают недифференцированные и бластные формы ге мопоэза. Такие лейкозы протекают остро и очень злокачественно.
При остановке дифференцирования на уровне процитарных и цитарных клеток-предшественниц лейкозы протекают хронически и менее злокачественно. - По цитогенетическому признаку острые лейкозы подразделяют на лимфобластный, миелобластный, монобластный, эритромиелобластный, мегакариобластный, недифференцированный. Хронические лейкозы делят на лейкозы миелоцитарного происхождения (хронический миелоцитарный, хронический нейтрофильный, хронический эозинофильный и др.), лимфоцитарного (хронический лимфолейкоз и парапротеинемические лейкозы — миеломная болезнь, первичная макроглобулинемия Вальденстрема и др.) и моноцитарного — хронический моноцитарный лейкоз, гистиоцитоз X.
- По иммунному фенотипу опухолевых клеток: на основании выявления маркеров их антигенов.
- По общему количеству лейкоцитов в периферической крови выделяют лейкозы:
- лейкемические — десятки и сотни тысяч лейкоцитов в 1 мкл крови, в том числе бласты;
- сублейкемические — число лейкоцитов крови составляет 25—50 • 109/л, включая бластные формы;
- лейкопенические — количество лейкоцитов в периферической крови ниже нормы, но есть бласты;
- алейкемические — количество лейкоците» в крови меньше нормы и отсутствуют бластные формы.
- По характеру течения выделяют:
- острые лейкозы (они же недифференцированные и бластные);
- хронические лейкозы (цитарные).
Острые лейкозы развиваются из всех ростков морфологически недифференцируемых кроветворных клеток-предшественниц. Длительность течения заболевания составляет 2—18 мес, при успешном лечении ремиссии могут длиться до 5—8 лет.
Морфогенез.
Различные формы острых лейкозо» имеют стереотипные морфологические проявления. Они заклинаются в развитии лейкозной инфильтрации костного мозга атипичными клетками ранних стадий гемопоэза (рис. 44). Ввиду нецифференциро-ванности этих клеток их цитогенетическую принадлежность можно выявить лишь с помощью цитохимических и иммуногистохи-мических методов. Костный мозг трубчатых костей становится красным, при некоторых острых лейкозах он приобретает зеленоватый цвет, свойственный гною, — пиоидный костный мозг. При этом происходит вытеснение нормальных клеток гемопоэза опухолевыми клетками. В периферической крови и в костном мозге имеются только бластные и зрелые формы клеток, но отсутствуют их промежуточные формы. Такая картина крови называется «лейкемический провал«. Лейкозные инфильтраты обнаруживаются в лимфатических узлах, селезенке и печени, что приводит к увеличению воспаления полости рта и ткани миндалин осложняется некротическим гингивитом, тонзиллитом, некротической ангиной, а при инфильтрации оболочек мозга развивается лейкозный менингит. Подавление эритроцитарного ростка приводит к нарастающей гипоксии и жировой дистрофии паренхиматозных органов.
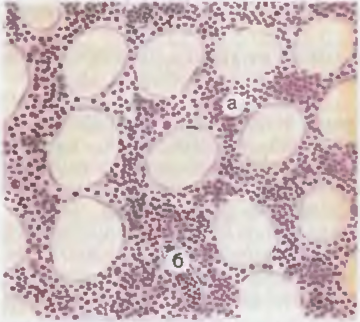
Рис. 44. Костный мозг при остром лимфобластном лейкозе. Ткань мозга состоит в основном из лимфобластов (а), просветы сосудов заполнены теми же клетками (б).
В результате тромбоцитопении, поражения печени и стенок сосудов у больных развивается геморрагический синдром вплоть до кровоизлияний в мозг и смертельных желудочно-кишечных кровотечений. На этом фоне иногда присоединяется сепсис, приводящий больных к смерти (рис. 45).
Наиболее часто, особенно у детей, встречается острый лимфобластный лейкоз, связанный с опухолевой трансформацией предшественников Т- и В-лимфоцитов, и острый миелобластный лейкоз, которым чаще страдают взрослые, обусловленный опухолевой пролиферацией клеток-предшественниц миелоидного ряда.
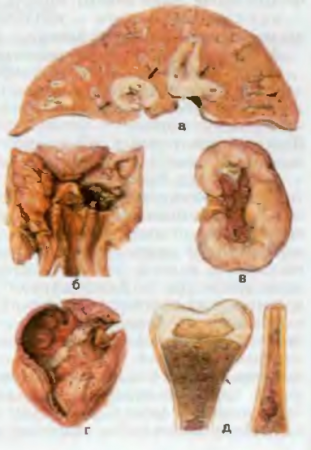
Рис. 45. Острый лейкоз, а — лейкозная инфильтрация печени (показано стрелками); б — некроз миндалины (некротическая ангина); в — лейкозная инфильтрация почек; г — множественные кровоизлияния в эпикарде и эндокарде; д — лейкозная инфильтрация костного мозга (пиоидный костный мозг), истончение кортикального слоя бедренной кости (показано стрелкой).
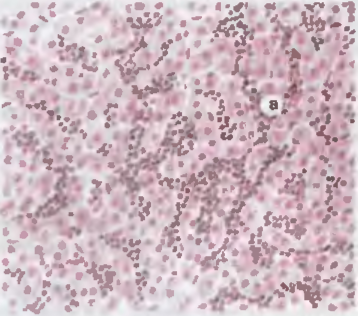
Рис. 46. Печень при хроническом миелолейкозе. Разрастание клеток миелоидного рода (а) по ходу синусоидов.
Хронические лейкозы текут более 4 лет, при успешном лечении ремиссии заболевания могут продолжаться 20 лет и более. Хронические лейкозы отличаются от острых цитарной дифференцировкой опухолевых клеток и более длительным течением, которое имеет определенные стадии:
- моноклоновая стадия характеризуется присутствием только одного клона опухолевых клеток, течет годами, относительно доброкачественно;
- поликлоновая стадия, или властный криз, связана с появлением вторичных опухолевых клонов, характеризуется быстрым злокачественным течением, и 80 % больных погибают именно в этой стадии.
Морфогенез.
Лейкозные инфильтраты разрастаются в костном мозге, печени, селезенке, почках, в лимфатических узлах, брыжейке кишечника, нередко в средостении, в связи с чем эти органы и ткани резко увеличиваются в размерах и могут сдавливать соседние органы (рис. 46). Особенно выражена спленомегалия (масса селезенки достигает 6—8 кг) и гепатомегалия (масса печени 5—6 кг). В сосудах образуются лейкозные тромбы, которые могут привести к развитию ишемических инфарктов, чаще в селезенке и почках. В крови нарастает количество нейтрофильных лейкоцитов или лимфоцитов, много переходных клеточных форм. Выражена анемия, тромбоцитопения, значительная иммунодепрессия и предрасположенность к инфекционным осложнениям, от которых больные нередко погибают. Костный мозг серо-красный. Жировая дистрофия паренхиматозных органов придает им серо-желтую окраску.
Доброкачественное течение сменяется бластным кризом. При этом в крови быстро нарастает количество бластных форм — миело-, эритро-, лимфо-, мегакариобластов и др. Общее число лейкоцитов периферической крови может достигать несколько миллионов в 1 мкл. Властный криз служит причиной смерти больных.
ПАРАПРОТЕИНЕМИЧЕСКИЕ ЛЕЙКОЗЫ
Парапротеинемические лейкозы характеризуются способностью опухолевых клеток синтезировать однородные иммуноглобулины или их фрагменты — парапротеины. При этом опухолевые клетки представляют собой атипичные плазмоциты и поэтому сохраняют способность в извращенной форме синтезировать атипичные иммуноглобулины.
Миеломная болезнь (плазмоцитома) — хронический лейкоз, наиболее часто встречающийся среди парапротеинемических гемобластозов.
Возникает в основном у взрослых и при современных методах лечения может продолжаться 4—5 лет. В основе болезни лежит опухолевое разрастание в костном мозге атипичных плазмоцитов, получивших название миеломных клеток. Они синтезируют парапротеины, которые обнаруживаются в крови и моче больных. По характеру и распространенности опухолевого инфильтрата в костном мозге выделяют узловатую и диффузную формы болезни.
При узловатой форме плазмоцитома образует опухолевые узлы в костном мозге, обычно плоских костей (свода черепа, ребер, таза) и позвонков. Лейкозная инфильтрация сопровождается разжижением кости или ее пазушным рассасыванием (остеолизис и остеопороз) с образованием правильной формы округлых дефектов, которые на рентгенограмме выглядят как гладкостенные пробоины. Пазушное рассасывание обусловливает выход кальция из костей и развитие гиперкальциемии с появлением множественных известковых метастазов в мышцах и паренхиматозных органах. Кроме того, возникают патологические переломы костей.
При генерализованной форме миеломной болезни разрастание миеломных клеток происходит, помимо костного мозга, в селезенке, лимфатических узлах, печени, почках и других внутренних органах.
Морфогенез.
В периферической крови обнаруживаются аномальные иммунные белки (парапротеины), в том числе мелкодисперсный белок Бенс-Джонса, который легко проходит через почечный фильтр и выявляется в моче. В связи с большой концентрацией белка Бенс-Джонса развивается парапротеинемический нефроз. Кроме того, в связи с нарушениями нормального синтеза иммунопротеинов плазмоцитома часто осложняется развитием амилоидоза с поражением почек. Поэтому причиной смерти этих больных нередко является уремия. Из-за резкого угнетения функции иммунной системы к основному заболеванию может присоединяться вторичная инфекция, которая также служит причиной смерти больных миеломной болезнью.
ЗЛОКАЧЕСТВЕННЫЕ ЛИМФОМЫ (ГЕМАТОСАРКОМЫ)
Злокачественные лимфомы (гематосаркомы) — регионарные злокачественные опухоли лимфоидной ткани, имеющие моноклоновое происхождение.
Лимфомы развиваются из незрелых форм лимфоцитов и поражают лимфатическую ткань какой-либо одной области, однако в терминальной стадии заболеваний возможна генерализация опухолевого процесса с развитием метастазов в костный мозг.
Этиология.
Причины возникновения злокачественных лимфом в принципе не отличаются от причин, вызывающих опухоли другого происхождения. Вместе с тем доказано, что часть лимфом. так же как и некоторые другие лейкозы, имеет вирусное происхождение. Не исключена и наследственная предрасположенность к заболеванию. Трансформация нормальных гемопоэтических клеток в опухолевые происходит в результате изменений в геноме, вследствие чего нормальная генетическая программа гемопоэза изменяется в направлении опухолевого атипизма.
Классификация лимфом.
- По клинико-морфологическим особенностями:
- лимфогранулематоз, или болезнь Ходжкина;
- неходжкинские лимфомы.
- По источнику роста (цитогенезу):
- В-лимфоцитарные;
- Т-лимфоцитарные.
- По степени дифференцировки опухолевых клеток:
- низкой злокачественности;
- умеренной злокачественности;
- высокой злокачественности.
Лимфогранулематоз (болезнь Ходжкина) описан в 1832 г. английским врачом Т. Ходжкиным. Частота заболевания составляет 3 случая на 100 000 населения, или 1 % всех злокачественных новообразований. Опухоль поражает лимфатические узлы обычно одной области — шейные, медиастинальные, забрюшинные, реже подмышечные или паховые.
Морфогенез.
Пораженные лимфатические узлы увеличиваются в размерах, сливаются между собой и образуют крупные пакеты. В начале заболевания лимфатические узлы мягкие, на разрезе розового цвета. По мере прогрессирования лимфомы в них развиваются некротические, а затем склеротические изменения, в связи с чем лимфатические узлы уплотняются, на разрезе выглядят суховатыми и пестрыми. В своем развитии лимфогранулематоз проходит несколько стадий — от изолированного поражения группы лимфатических узлов до генерализованного поражения внутренних органов с подавлением лимфоидной ткани и замещением ее полями склероза.
При микроскопическом исследовании опухоль состоит из полиморфных опухолевых клеток лимфоцитарного ряда, среди которых имеются характерные гигантские клетки с лопастным ядром и узким ободком цитоплазмы — клетки Березовского—Штернберга. Эти клетки служат диагностическим признаком лимфогранулематоза. Кроме того, характерны клетки Ходжкина — крупные клетки с большим светлым ядром и темным ядрышком.
Нередко в финале заболевания оно приобретает генерализованный характер с поражением многих внутренних органов — желудка, легких, печени, кожи. При вскрытии умерших от лимфогранулематоза особенно демонстративно выглядит селезенка — она увеличена в размерах, плотная, на разрезе красная с множественными бело-желтыми очагами некроза и склероза, что придает ей сходство с особым видом гранита — порфиром (порфировая селезенка).
Неходжкинские лимфомы.
Это группа злокачественных опухолей из недифференцированных и бластных форм В- и Т-клеток лимфатической ткани. Диагноз этих заболеваний требует обязательного морфологического и иммуногистохимического исследования биоптатов лимфатичесих узлов.