Эффективность антигистаминов при бронхиальной астме у детей не велика, так как гистамин только один из медиаторов, участвующих в патогенезе аллергического воспаления. Однако ранний и поздний бронхоконстрикторный ответ на ингаляцию аллергена сопровождаются увеличением концентрации гистамина в крови. В дополнение к блокаде Hi-рецепторов антигистамины могут стабилизировать тучные клетки, выступать в качестве антагонистов лейкотриенов или тромбоцитактивирующего фактора, улучшать регуляцию бета-2-адренорецепторов, ингибировать аккумуляцию эозинофилов [Peachell Р.Т. etal., 1989; Marone G., 1997]. Все это определяет вклад антигистаминов в эффект терапии бронхиальной астмы.
В некоторых исследованиях показано, что антигистамины предотвращают развитие приступов бронхиальной астмы вызванных гистамином и физической нагрузкой, а также облегчают легкие астматические проявления [Slater J.W. etal., 1999]. Как показано в рамках международной программы ETAC (Early Treatment of the Atopic Child) назначение детям первых лет жизни с экземой и повышенным общим уровнем IgE це-тиризина предотвращало или замедляло развитие бронхиальной астмы [Warner J.О. etal., 1998]. По данным исследований ингибирующих свойств антигистаминов разных поколений на провокационную пробу с гистамином наибольшими потенциальными возможностями в ингибиции бронхоспазма, вызванного гистамином, обладают цетиризин и терфенадин [MaroneG., 1997].
На современном этапе антигистамины при бронхиальной астме у детей могут быть использованы при:
- легкой бронхиальной астме;
- сезонной бронхиальной астме;
- бронхиальной астме вызванной физической нагрузкой;
- сочетании бронхиальной астмы и аллергического ринита (сезонного и круглогодичного);
- у детей с атопическим дерматитом для профилактики развития бронхиальной астмы.
Эффективность антигистаминов при аллергическом рините. Четко показано, что антигистамины существенно уменьшают симптомы аллергического ринита. Нередко отмечается сочетание различных проявлений аллергии у одного ребенка. Около 38% больных с ринитом имеют астму и у 80-90% больных с астмой отмечается сопутствующий хронический ринит. Исследования свидетельствуют о том, что назальная аллергия может играть важную роль в изменении функции нижних дыхательных путей за счет прямого и непрямого действия. Наличие аллергического ринита рассматривается как фактор риска развития бронхиальной астмы. У 80% взрослых и 70% подростков аллергические симптомы со стороны верхних дыхательных путей начинаются раньше или одновременно с началом бронхиальной астмы.
На основе экспериментальных моделей показано, что аллергический ответ со стороны верхних и нижних дыхательных путей при рините и бронхиальной астме сходен. При этом имеют место ранняя и поздняя фазы аллергической реакции. В итоге в аллергический процесс вовлекается весь респираторный тракт. При этом гистамин выступает главным медиатором, а терапия антигистаминами приносит положительный результат.
Эффективность при атопическом дерматите. Хлоропирамин (супрастин), дифенгидрамин (димедрол) и гидроксизин (атаракс), прометазин (дипразин, пипольфен) часто используются для подавления зуда при атопическом дерматите у детей. Антигистамины второго поколения также широко используются при этом заболевании.
Безопасность.
Новое поколение антигистаминов по сравнению с первым реже вызывают побочные эффекты. Эти препараты не увеличивают частоту апноэ у грудных детей, не влияют на функцию центральной нервной системы, что подтверждено исследованиями с оценкой ЭЭГ.
Антигистамины второго поколения имеют особенности фармакокинетики. Так, терфенадин подвергается метаболизму в печени при первом прохождении и превращается в кислый метаболит, активность которого составляет 70% от родительского и, возможно, определяет многие эффекты препарата. Пик концентрации метаболита в плазме достигается через 2,5 ч после приема, с последующим падением. Период полувыведения составляет 3,5 ч. Препарат назначают 2 раза вдень. Метаболизм терфенадина проходит через систему печеночного цитохрома Р-450, которая может блокироваться рядом препаратов. В результате аккумуляция высоко активного, но потенциально токсичного родительского компонента, хотя и редко, но может привести к тяжелым побочным эффектам. У детей до 12 лет зрелость цитохрома Р-450 недостаточная.
Астемизол также подвергается метаболизму цитохромом Р-450, и гидроксилированные метаболиты также активны, как исходное средство. Элиминация родительской фракции и активных метаболитов очень медленная, период полувыведения около 7-9 дней. В результате необходим длительный ежедневный прием препарата для получения стабильного уровня. Соответственно клинический эффект наступает медленно и в случае развития побочного эффекта последний может носить персистирующий характер. Начальная доза не должна превышать 10 мг/сут, так как возрастает опасность побочного действия.
Эбастин (кестин) почти полностью метаболизируется в печени, превращаясь в активный метаболит каребастин. Отличительной особенностью эбастина является быстрое начало действия (максимальная концентрация в крови после однократного приема 10 мг достигается через 2,5 ч. Период полувыведения у детей составляет — 10-11 ч [Simons F.E.R. etal., 1993].
При ежедневном приеме стабильная концентрация достигается через 3-5 дней и составляет 130-160 нг/мл. Связывание с белками плазмы эбастина и коребастина составляет более 95% [Slater J.W. et al., 1999]. Выводится в виде конъюгатов с мочой. При назначении препарата одновременно с приемом пищи уровень в крови возрастает в 1,6-2 раза. Однако это существенно не влияет на клинические эффекты. Было показано [Геппе Н.А. ссоавт., 1999], что эбастин является высокоэффективным препаратом при аллергических ринитах у подростков и приводит к исчезновению симптомов аллергического ринита у 80% детей. В случае недостаточного эффекта эбастина в дозе 10 мг, у детей с выраженными симптомами ринита, дозу препарата увеличивают до 20 мг и удлиняют продолжительность терапии. Эбастин назначают детям старше 12 лет по 10 мг (1 табл.) 1 раз в сутки.
Лоратадин (кларитин) метаболизируется при первом прохождение через печень. В результате его метаболиты (декарбоэтоксилоратадин) рассматриваются как активные, но их активность составляет около 1% от родительского препарата. Период его полувыведения составляет 8-14 ч и для метаболитов 17-24 ч, что позволяет назначать препарат 1 раз в день с быстрым началом действия. Кларитин применяется с возраста 2 лет. Кларитин относится ко второму поколению неседативных блокаторов антигистаминовых рецепторов, не оказывает побочного действия на сердечно-сосудистую систему. Кроме того, регулирует экспрессию ICAM-1 на поверхности эпителиальных клеток. Фармакологическая профилактика развития и прогрессирования бронхиальной астмы является важной задачей педиатрии. В 1996 году в 23 странах начата программа раннего предотвращения развития бронхиальной гиперреактивности и аллергии у детей из групп риска в двойном плацебо-контролируемом исследовании. После 12 месячного лечения лоратадином детей первых лет жизни наблюдение за ними в течение года показало снижение на 33% частоты обструктивного синдрома по сравнению с группой получавших плацебо [Grimfeld A. et al., 2000].
Цетиризин (зиртек) не подвергается выраженному метаболизму при первом прохождении через печень, и не имеет значительных активных метаболитов. Элиминируется через почки, период полувыведения от 8,6 до 9,4 ч. Метаболизм препарата у детей происходит значительно быстрее, чему взрослых. Полураспад препарата у детей моложе 4 лет составляет до 4,9ч, у взрослых 8,6-9,4ч [Nightingale С. Н., 1996, MaroneG., 1997]. Назначают детям с первых лет жизни дважды в день.
Фексофенадин (телфаст) представляет собой конечный активный метаболит терфенадина и относится к самому современному поколению антигистаминов, так называемым метаболитам. Телфаст не претерпевает биотрансформации в печени и поэтому не взаимодействует с другими лекарствами метаболизирующимися печенью. Фексофенадин предназначен для устранения аллергических проявлений. Назначается детям старше 6 лет. Высокая эффективность препарата при аллергических проявлениях определяется снижением экспрессии молекул адгезии (ICAM-1), хемотаксиса эозинофилов, предупреждает гиперреактивность дыхательных путей. Для детей от 6 до12 лет зарегистрирована детская форма в виде таблеток, содержащих 30 мг препарата (1-2 таблетки в сутки). При проведении клинических испытаний было показано, что фексофенадин не влияет на функции центральной нервной системы, не проникает через гематоэнцефалический барьер, не обладает седативным действием, антихолинергической и антиадренергической активностью, быстро начинает действовать.
Рациональное, своевременное назначение базисной терапии бронхиальной астмы и аллергического ринита может обеспечить длительную ремиссию, предотвратить прогрессирование аллергической патологии. У детей с бронхиальной астмой и аллергическим ринитом, получавших базисную терапию кромогликатом натрия, отмечено положительное действие дополнительного назначения антигистаминного препарата телфаст в дозе 120 мг [Геппе Н.А., 2000; Макарова И.В., 2000]. При этом не только восстановилось носовое дыхание, исчез зуд и ринорея, но и улучшилась бронхиальная проходимость, исчезла необходимость в симптоматической терапии бронхолитиками. Положительный эффект при одновременном назначении этих лекарственных средств можно объяснить суммацией подавления аллергической реакции немедленного типа телфастом с воздействием на клеточное звено аллергического воспаления кромогликатом натрия.
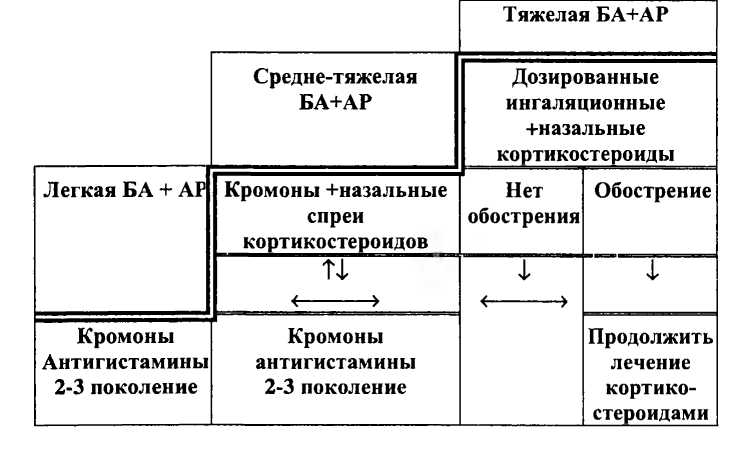
При сочетании бронхиальной астмы и аллергического ринита может использоваться принцип ступенчатого подхода к назначению базисной терапии (схема 16-1).
При легкой или средне-тяжелой бронхиальной астме в сочетании с аллергическим ринитом эффективной является комплексная терапия, включающая кромоны и антигистаминные препараты второго поколения. Уменьшение воспалительного процесса в верхних дыхательных путях, способствует восстановлению носового дыхания, приводит к уменьшению раздражающего действия факторов окружающей среды.
Гипотеза стабилизации тучных клеток антигистаминами появилась около 30 лет тому назад [Seeman R, 1972]. Стабилизация мембраны тучных клеток наряду с неспецифическим действием определяется ингибицией связывания ионов Са с клеточной мембраной и снижения выделения медиаторов аллергии [Radermecker М., 1981]. Недавние исследования это также подтверждают. По мере повышения концентрации препаратов мембрана может потерять структурную устойчивость с последующим выделением преформированных медиаторов. Все это заставляет более пристально оценивать процессы действия лекарственных препаратов в организме ребенка.
Таким образом, эффективность антигистаминов при бронхиальной астме у детей не велика, так как гистамин только один из медиаторов, участвующих в патогенезе аллергического воспаления. Применение их имеет свои показания. При этом используются антигистамины второго поколения, которые обладают большей специфичностью к Н1-гистаминовым рецепторами, длительностью действия и лишены седативного эффекта.
Применение антигистаминов у детей раннего возраста (кларитин, зиртек) с проявлениями атопического дерматита уменьшает риск развития в последующем бронхиальной астмы. Комплексная терапия, включающая кромоны и антигистаминные препараты второго поколения, эффективна при легкой и средне-тяжелой бронхиальной астме в сочетании с аллергическим ринитом. Рациональное, своевременное назначение базисной терапии бронхиальной астмы и аллергического ринита, использование принципа ступенчатого подхода может обеспечить длительную ремиссию, предотвратить прогрессирование аллергической патологии.
Литература
- Н.А.Гоппе, А.В.Карпушкина, М.Н.Снегоцкая, А.К.Васудеван. Антигнистаминные препараты в комплексной терапии бронхальной астмы и аллергического ринита у детей. // Рос. псд. журн. — 1999, № 4. — С. 45-48.
- Н.А.Геппс. Антагонисты Н1-рецепторов в лечении бронхиальной астмы у детей. // Consilium modicum. — 2000. — Т.2, №10. — С. 414-418 Макарова И В. Применение препарата Телфаст в лечении аллергических заболеваний дыхательных путей у детей. // Аллергология. — 2000. — №4. — С. 18-20. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». Москва, 1997.
- Arrang J.-M., Garbarg М., Lanceljt J.-C. et al. Highly potent and selective ligands for histamine H3-receptors. // Nature. — 1987. — 327. — p. 117-23.
- Asthma and allergic diseases (Phisiology, immunopharmacology and treatment). Ed / G. Marone, K. Frank Austen, S. T. Holgate. — Fifth Internationa] Symposium, Italy, 1997.
- Ash A.S.F., Scild H.O. Receptors mediating some actions of histamine. // Br J Pharmacol. — 1966.-27. — p. 427-39.
- Black J.W., Duncan W.A.M. et al Definition and antagonism of histamine H2 receptors. // Nature. — 1972. — 236. — p. 385-90 .
- Bousquet J., Campbell A.M., Canonica C.W. et al. HI-Receptor Antagonists: Structure and Classification. / In book: Histamine and HI-Receptor Antagonists in Allergic Disease. Ed. F.Estell R. Simons. — New York-Basel-Hong Kong. — 1996. — p. 91-117.
- Borea P.A., Bcrtolasi V, Gilli G. Crystalographic and conformational studies on histamine Hl-receptor antagonists. //Arzneimittelforschung. — 1986. — 36. — p. 895-9.
- Curry J. The effect of hystamine on respiratory tract in normal and asthmatic subjects. // J Clin Invest. — 1946. — 25. — p. 785-794.
- Dale H., Laidlaw P. The phisiological action of bimidazolethiaminc. //J Physiol (London). — 1910. 41. — 318-44. — p. 91.
- Grimfeld A., Holgate S.T., Adam D. et al Preventia study phase I results: Loratadine treatment reduces wheezihg episodes in children at risk for recurrent upper respiratory upper respiratory infections. — Preventia EAACI abstracts. — 2000.
- Estell F., Simons R. HI-Receptor Antagonists in Children In book: Histamine and Hl-Receptor Antagonists in Allergic Disease. — Ed. F.Estell R. Simons. — New Yorc-Basel-Hong Kong. — 1996. — part 12. — p. 329-56.
- Herxheimer H. Antihistamines in bronchial asthma. // Br Med J. — 1949. — 2. — p. 901. Ishizaka K., Ishizaka T, Terry W. Antigen structure of E globin and reaginic antibody. // J Immunol. — 1967. — 99. — p. 849-858.
- Kaplan A.P. Allergy (Second ed.). -N.Y. — 1997.
- Malick A., Grant J.A. Antihistamines in the treatment of asthma. //Allergy. — 1997. 52(34 Supple). — p. 55-66.
- Marone G Milestones in the biology and pharmacology of Hl-receptop antagonists. // Allergy 1997, 52 (34 Supple) 7-13
- Nightingale C.H. Treating Allergic Rhinitis with Second-Generation Antihistamines.Pharmacotherapy. — 1996. -16. — 5. — p. 905-914.
- Johansson S.,Bennich H. Immunological studies of an autosomal myeloma protein. // Immunology. — 1967. — 99. — p. 849-858.
- Pcachell P.T., Pearce F.L. Divalent cation dependence of the inhibition by phenotiazincs of mediator release from mast cells. // Br J Pharmacol. — 1989. — 97. — p. 547-55.
- Radcrmecker M. Inhibition of allergen-mediated hystamine release from human cells by ketotufen and oxatomidc; comparison with other Hl-antohistamines. // Respiration. -1981.-41. -p. 45-55.
- Seeman P. The membrane actions of anaesthetics and tranquillizers. // Pharmacol Rev. -1972.- 24.-p.;583-655.
- Slater J.W., Zechnich A.D., Haxby D.G. Second-Generation Antihistamines. // Drugs. -1999.-57 (1).-p. 31 47.
- Simons F.E.R., Watson W.T.A., Simons K.J. Pharmacokinctiks and pharmacodynamics of ebastine in children. // J.Paediatr. — 1993. — Vol. 122, — p. 641-646.
- Warner J.O., Businco L., Diepgen T.L. et al Allergic factors assosiated with the development of the asthma and the influence of cetirizine in a double-blinde, randomised, placebo-controlled trialA First results ofETAC. //Pediatr Allergy Immunol. 1998. -9. — p. 1 lb-124.
- Weiss S., Robb G., Ellis C The systemic effects of histamine in man. // Arch Heart J. -1929.-4,-p. 664-691.
- Yamashita M., Ito S et al Biochemical characterization of histamine Hl-receptor in bovine adrenal medulla. // Biochem Biophys Res Commun. — 1991. -177. — p. 1233-1239.