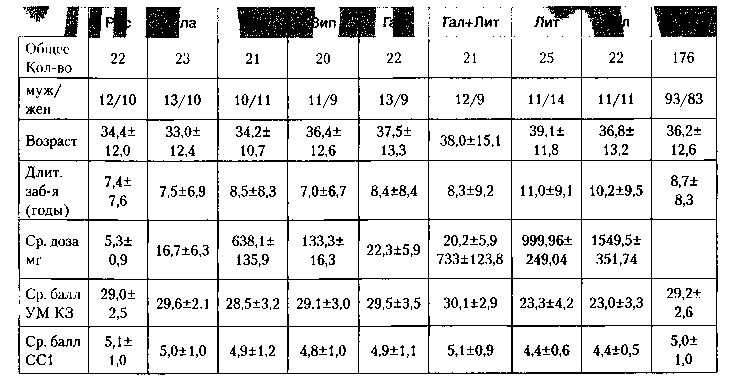
Целью проведенного исследования являлась оценка эффективности и безопасности антипсихотиков второго поколения при купировании маниакальных и маниакально-бредовых состояний. В открытое, сравнительное исследование было включено 176 пациентов с маниакальной симптоматикой в возрасте от 18 до 65 лет и суммарным баллом по шкале YMRS>20. Пациенты были разделены на группы и получали монотерапию рисперидоном (РИС) в средней дозе 5,3±0,9 мг/сут, оланзапином (ОЛА) -16,7±6,3 мг/сут, кветиапином (КВТ) — 638,1±135,9 мг/сут, зипрасидоном (ЗИП) — 133±16,3 мг/сут, галоперидолом (ТАЛ) — 22,3±5,9 мг/сут, комбинированную терапию галоперидолом и литием (ГАЛ+ЛИТ) — 20,2 ±5,9 мг/ cym и 733,3± 123,8 мг/сут, литием (ЛИТ) 999,96±249,1 мг/сут, вальпроатом натрия (ВН) — 1549,5±351,7 мг/сут в течение 6 недель.
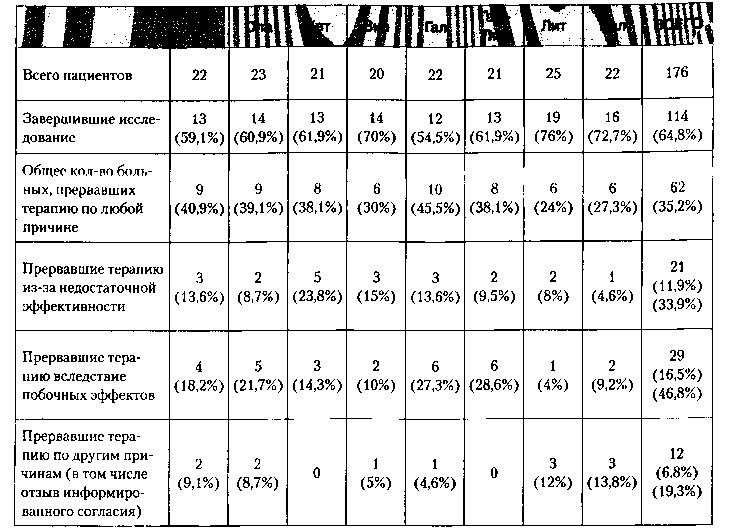
Оценка клинической эффективности и ее переносимости проводилась с использованием следующих шкал: YMRS, CGI-BP, MADRS, SAS. Процент редукции среднего балла по шкале YMRS составил 58,5% в группе ГАЛ+ЛИТ, ТАЛ — 55,9%, ОЛА -54,4%, ЛИТ — 53,5%, ЗИП — 52,5%, ВН — 51,9%, КВТ — 51,2%, РИС -49,3%. Число респондеров (50% редукция по шкале YMRS) к 42 дню в группе ЗИП составило 70%, ГАЛ+ЛИТ — 61,9%, ОЛА — 60,9%, РИС — 59,1%, КВТ — 57,2 %, ТАЛ — 57,1 %, ВН — 54,5 %, ЛИТ -52%. При оценке по шкале MADRS средний балл в группе ТАЛ увеличился на 9%. Из-за низкой терапевтической эффективности и возникновения нежелательных явлений (НЯ) выбыло из исследования 35,2% больных в группе ГАЛ+ЛИТ, 45,5% в группе ТАЛ, 40,9% — РИС, 39,1% — ОЛА, 38,1% — КВТ, 30% — ЗИП, 27,3% — ВН, 24% — ЛИТ. В группах ГАЛ+ЛИТ и ТАЛ преобладали экстрапирамидные расстройства (52,3% и 45,5% соответственно), в группе ОЛА и РИС -повышение массы тела более чем на 7% (21,7% и 13,6%), в группах КВТ, ЗИП, ЛИТ, ВН НЯ были нетяжелыми и не требовали изменения терапии. Выявленные особенности терапевтического действия позволяют осуществить дифференцированный подход к назначению препаратов при лечении маниакальных и маниакально-бредовых состояний.
С середины прошлого века на протяжении нескольких десятилетий соли лития, хлорпромазин и галоперидол были основной психофармакотерапии маниакальных состояний (МС). В дальнейшем к ним присоединились некоторые антиконвульсанты (вальпроат, кармабазепин). Появление новых лекарственных препаратов, в том числе атипичных антипсихотиков, расширило возможности в лечении острых маниакальных и маниакально-бредовых состояний. Но, несмотря на рост количества препаратов, рекомендуемых для купирования маний, эта патология остается проблемой для врачей-психиатров. Отчасти это связано также с тем, что около 50 % маниакальных эпизодов сопровождается бредовой симптоматикой, 15% — галлюцинаторной и 20% — острыми расстройствами мышления (Goodwin Е et al., 1990) и, в подавляющем большинстве, входят в структуру сложных синдромов (Hirschfeld R. et al., 2003). Хотя МС наиболее часто встречаются при биполярном аффективном расстройстве (БАР), они могут наблюдаться и при других психических расстройствах. Ошибочная диагностика влечет за собой неправильный выбор тактики ведения таких больных (Kasper S. et al., 2002; Angst J., 2006, Zimmerman M. et al., 2008). Все это нередко приводит к снижению качества жизни больного и неоправданной инвалидизации (Woods S. et al., 2000; Angst J., 2004; Runge C. et al., 2004). В среднем течение маниакального эпизода, даже без лечения, продолжается 1-3 месяца. Ввиду выраженного нарушения поведения больные манией чаще всего госпитализируются. Целью терапии в этих случаях является уменьшение двигательного возбуждения, импульсивности, агрессивности, нормализация поведения и купирование психотических симптомов. „Золотым стандартом» терапии МС являются препараты нормотимического действия (соли лития и соли вальпроевой кислоты) в виде монотерапии или в сочетании с классическими нейролептиками (галоперидолом) (Мосолов С.Н., 1983; Tohen М. et al., 2001; ChouJ. et al., 2006). Существенными недостатками терапии МС классическими нейролептиками, при их несомненной высокой клинической эффективности, является быстрое появление экстрапирамидных побочных эффектов (ЭПЭ) и возможность развития депрессивной симптоматики (Ahlfors U. et al., 1981). В последние годы стали появляться данные о хорошей эффективности и переносимости атипичных антипсихотиков (АА) в виде монотерапии или в сочетании с нормотимиками при купировании МС при БАР (Vieta Е. et al., 2000; Tohen М. et al., 2002; Sachs G. et al., 2002, 2003; Yatham L. et al., 2003; Mullen J. et al., 2003; Canuso C. et al., 2003; Grunze H. et al., 2009).
Так, в двойном слепом рандомизированном исследовании, где сравнивались оланзапин и рисперидон (Perils R. et al., 2006) статистических различий в антиманиакальном действии препаратов найдено не было. При сравнении оланзапина с галоперидолом (Tohen М. et al., 2003) также различий не было, около 70% респондеров в обеих группах были выявлены к 6-й неделе терапии. В 4-недельном исследовании оланзапин превзошел литий по антиманиакальному действию, однако у этого нейролептика было зафиксировано достоверно большее количество побочных эффектов, включая увеличение веса (Niufan G. et al., 2008). При сравнительном изучении антиманиакального эффекта кветиапина была показана его равная эффективность с литием (Bowden С. et al., 2005), а галоперидол показал более быстрое начало действия (McIntyre R. et al., 2005) и лучшую эффективность (Scherk Н. et al., 2007). Рисперидон обнаружил равную эффективность при МС в сравнении с галоперидолом (Segal J. et al., 1998; Smulevich A. et al., 2005; Scherk H. et al., 2007), но превзошел литий (Segal J. et al., 1998). При этом исследователями отмечаются развитие экстрапирамидной симптоматики и увеличение уровня пролактина в крови. При сравнении зипрасидона с галоперидолом было продемонстрировано схожее антиманиакальное действие препаратов (Vieta Е. et al., 2010). В другом исследовании галоперидол превосходил зипрасидон по эффективности, но уступал в профиле безопасности (Warrington L. et al., 2007).
Детальный обзор современных доказательных исследований показывает, что преимущество АА по сравнению с традиционными нейролептиками заключается не столько в эффективном контроле психомоторного возбуждения и других маниакальных симптомов, сколько в их лучшей неврологической переносимости (Мосолов С.Н., Шафаренко А. А., 2009). Монотерапия АА не уступает по эффективности традиционным схемам лечения, а в сочетании с нормотимиками АА в ряде случаев позволяют добиться большего успеха (Tohen М. et al., 2002; Sachs G. et al., 2002; Mullen J. et al., 2003). Вместе с тем, при применении АА нередко развиваются нейроэндокринные и метаболические нарушения, что необходимо учитывать при выборе антиманиакальной терапии (Meltzer Н., 1998; Kane J. et al., 2004).
Целью настоящей работы являлась оценка сравнительной эффективности и переносимости атипичных антипсихотиков при терапии маниакальных и маниакально-бредовых состояний в рамках биполярного аффективного расстройства I типа и шизоаффективного расстройства.
Методика исследования
В исследование включались больные мужского и женского пола от 18 до 65 лет, подписавшие добровольное информированное согласие на участие в исследовании, с диагнозом по МКБ-10: шизоаффективное расстройство, маниакальный тип (F25.0), шизоаффективное расстройство, смешанный тип (F25.2), маниакальный эпизод (F30.0), биполярное аффективное расстройство, текущий эпизод мании и смешанный эпизод (F31.0, 31.1, 31.2, 31.6). Критериями исключения были непереносимость назначаемых нейролептических и нормотимических препаратов, органическое поражение ЦНС, беременность или кормление грудью, недавнее или постоянное злоупотребление лекарственными препаратами или алкоголем, за исключением никотина и кофеина, тяжелые сердечно-сосудистые, гематологические, эндокринологические или соматические заболевания, а также прием в течение предшествующих 14 дней нейролептика, антидепрессанта или введение депонированных форм нейролептиков в течение месяца, электросудорожная терапия — 3 месяца до рандомизации.
Перед назначением препарата каждый пациент в течение 1-5 дней прошел период „отмывки». Больным в случайном порядке перорально назначался один из следующих исследуемых препаратов: рисперидон, оланзапин, кветиапин, зипрасидон, галоперидол, вальпроат натрия, литий или сочетанная терапия галоперидолом и литием в течение 6 недель (42 дня). Оценка динамики психопатологической симптоматики по шкалам проводилась до начала лечения (ДО), затем на 4-й (Д4), 7-й (Д7), 14-й (Д14), 28-й (Д28) и 42-й (Д42) дни терапии или в момент досрочного выбывания больного из исследования. Рисперидон назначался в дозировке от 1 до 6 мг/сут, оланзапин -5-30 мг/сут, кветиапин — 400-800 мг/сут, зипрасидон — 80-160 мг/ сут, галоперидол — 5-30 мг/сут, литий — 600-1200 мг/сут, вальпроат натрия — 600-1800 мг/сут.
В соответствии с клиническим решением и концентрацией препарата в крови доза нормотимика подбиралась таким образом, чтобы концентрация вальпроата в плазме крови была в диапазоне от 70 до 125 мкг/мл, а концентрация лития в крови — в диапазоне от 0,8 до 1,2 ммоль/л.
Была запрещена сопутствующая терапия любым другим психотропным лекарственным средством, которое могло бы повлиять на оценку безопасности и эффективности назначаемой терапии. Из разрешенных препаратов мог назначаться лоразепам (до 8 мг/сут с ДО до Д7; до 4 мг/сут с Д7 до Д42) или эквивалентная доза диазепама или других бензодиазепинов для контроля ажитации, раздражительности или тревоги. Корректор нейролептической терапии (тригексифенидил) применялся при развитии ЭПЭ. При бессоннице разрешалось применение снотворных препаратов (золпидем 10 мг или зопиклон 7,5 мг на ночь).
Больной мог в любое время и по любой причине досрочно прекратить лечение по собственному решению или по решению врача.
Первичным критерием эффективности было среднее изменение общего балла по шкале мании Young Mania Rating Scale (YMRS) (Young R. et al., 1978) относительно исходного уровня к концу исследования. Вторичными критериями, которые использовались для оценки эффективности лечения, были число респондеров (50 % и более редукция симптоматики по шкале YMRS) на визите Д42, число пациентов, достигших ремиссии (YMRS<8, MADRS<8) на визите Д42, динамика общего балла по шкалам CGI-BP (Clinical Global Impression — Bipolar Version) (Spearing M. et al., 1997), MADRS (Montgomery S. A., Asberg M. A., 1979), SAS (Simpson G., Angus J., 1970).
Для определения безопасности и переносимости терапии проводилась регистрация всех побочных эффектов (неврологических, сомато-вегетативных и др.), возникших во время приема препаратов. Показатели жизненно важных функций (артериальное давление, пульс) и масса тела измерялись при каждом визите. Лабораторные анализы, включающие общую гематологию, биохимию крови и функцию щитовидной железы, были выполнены перед назначением терапии и на последнем визите. Стандартное ЭКГ проводилось на ДО и Д42 или при досрочном выбывании. Концентрация вальпроата и лития в сыворотке крови оценивалась на Д7 и Д42 или при досрочном выбывании из исследования.
Статистический анализ результатов исследования проводился с использованием пакета прикладных программ Statistica версия 6.0. Для оценки безопасности был использован метод анализа данных всех больных, включенных в исследование. Для оценки эффективности использовался метод анализа данных больных, принявших хотя бы одну дозу исследуемого препарата и имеющих хотя бы одну оценку эффективности после исходной. Для больных, досрочно выбывших из исследования, пропущенные данные замещались последним доступным наблюдением (LOCF) (баллы по шкалам YMRS, CGI-BP, MADRS, SAS). Демографические и исходные клинические характеристики больных оценивались методами описательной статистики. Для количественных данных определялись среднее значение, стандартное отклонение, медиана и диапазон значений. Качественные данные представлялись в виде абсолютных и относительных частот. Сравнение эффективности между группами выполнялось с использованием критерия Манна-Уитни. Терапевтическая динамика по шкале YMRS в группах оценена с помощью критерия Вилкоксона для зависимых переменных. Критерий х-квадрат использовался для поиска статистических различий между группами по числу респондеров.
Характеристика включенных больных и анализ выбывших из исследования
Всего в исследование вошло 176 пациентов, которые были распределены в одну из восьми групп терапии. Среди включенных в исследование пациентов было 52,8 % мужчин и 47,2 % женщин. Средний возраст пациентов составлял 36,2±12,6 лет в диапазоне от 18 до 65 лет. Статистически значимых различий между группами по социально-демографическим и антропологическим характеристикам выявлено не было. Средняя продолжительность биполярного расстройства у пациентов составляла 8,7±8,3 лет. Подавляющее большинство больных наблюдалось в стационарных условиях, и их состояние характеризовалось достаточной остротой маниакального состояния. Так, сумма баллов по шкале YMRS в среднем составила от 28,5 в группе кветиапина до 30,1 в группе галоперидола и лития; средний балл по шкале CGI-BP составлял от 4,8 в группах вальпроата и зипрасидона до 5,1 -в группе галоперидола и лития и в группе рисперидона (табл. 1).
Число пациентов, завершивших 6-недельный этап терапии, колебалось от 55% в группе галоперидола и лития до 76% пациентов в группе лития. Всего из исследования выбыло 35,2 % пациентов. И если в группах рисперидона, кветиапина, вальпроата процент выбывших из исследования был больше за счет недостаточной эффективности препарата и других причин, включая „отзыв информированного согласия», то в группах оланзапина и галоперидола из-за плохой переносимости препарата (табл. 2).
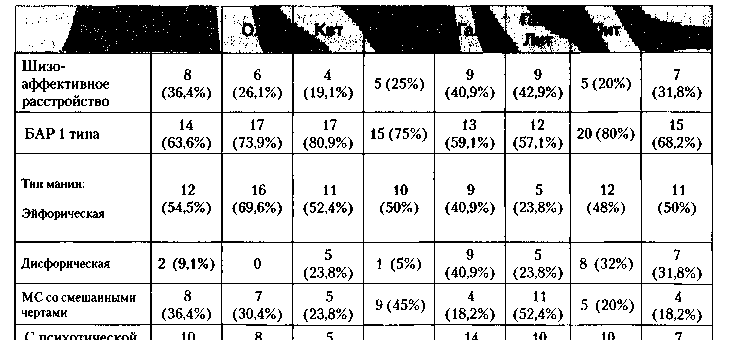
У большинства пациентов был диагностирован маниакальный эпизод БАР I типа (69,9%), у других (30,1 %) было диагностировано шизоаффективное расстройство. По типу мании больше всего пациентов было с эйфорической („веселой») манией — 86 человек, с дисфорической („гневливой») манией — 37 и МС со смешанными чертами — 53. У 40 % пациентов наблюдалась психотическая (бредовая) симптоматика (табл.З).