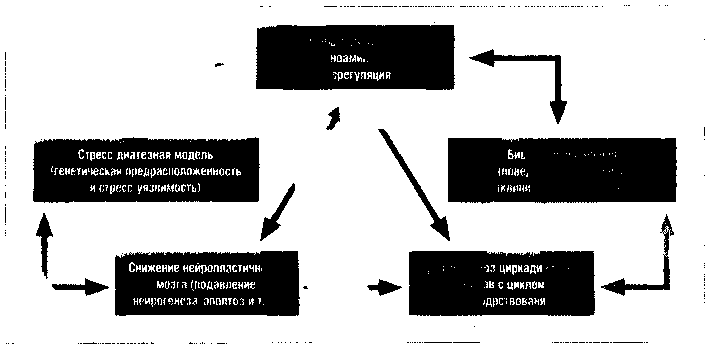
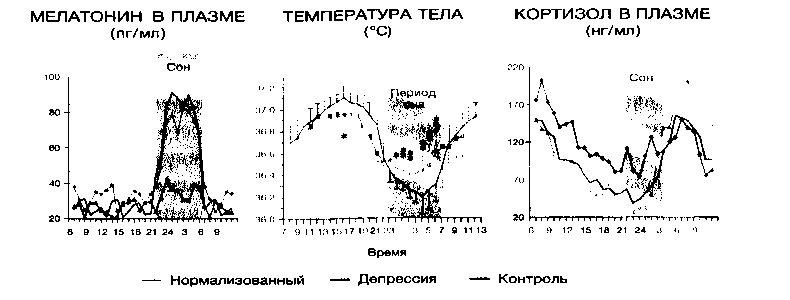
Наряду с достаточно хорошо известными отечественным врачам нейромедиаторной (моноаминовой), биопсихосоциальной (поведенческой) и стресс-диатезной моделями (генетическая предрасположенность и стресс-уязвимость) развития депрессии, в последние годы внимание ученых было привлечено к вопросам снижения при депрессии нейропластичности мозга (подавление нейрогенеза, апоптоз и т. д.) и явлению десинхроноза циркадианных ритмов с циклом сон-бодрствование (хронобиологическая модель) (рис. 1).
В настоящее время, по-видимому, трудно оспорить постулат, что ритмическая активность является фундаментальной характеристикой живой материи. Хронобиологические имманентные свойства и процессы, эволюционно сформировавшиеся под влиянием макро и микроколебаний природных факторов, пронизывают жизнедеятельность человеческого организма на всех уровнях от молекулярноклеточного до психического и социального. Взаимодействие между ритмами разной периодичности (их взаимопроникновение и взаимомодулирование) обеспечивает гибкость реагирования организма на влияние внешних факторов, поддерживает в рабочем режиме важнейшие гомеостатические функции и поэтому имеет глубокий эволюционно-биологический смысл, заключающийся в формировании защитно-адаптационных механизмов и динамической интеграции в окружающую среду. Ритмическая организация организма представляет собой строго иерхарическую систему топологической структуры и подчиняется определенным закономерностям.
В этой системе важным связующим макро- и микроритмы звеном является циркадианный ритм, которому подчиняется большинство функций организма, в том числе нейрофизиологические. Цикл сон-бодрствование представляет собой интегрированный в циркадианный ритм сложный феномен, обеспечивающий согласованность биоритмов различной периодичности. Поэтому сон, являющийся своеобразным перекрестком, местом взаимодействия ультра, цирка и инфрадианных ритмов, служит идеальной и доступной моделью для изучения биологической ритмики при психических заболеваниях, нарушение которой издавна привлекало внимание клиницистов, особенно при обследовании больных с фазнопротекающими аффективными расстройствами.
Филогенетически сон формировался из циркадианного ритма отдых-активность, который несет адаптивную функцию снижения уровня метаболизма и спонтанной моторной активности и свойственен всем живым существам. В эволюционном аспекте ограниченность этой модели состояла в жесткой хронодетерминированности ритма и отсутствии достаточной гибкости реагирования на внезапные внешние воздействия в период «отдыха». По-видимому, не случайно ритмические процессы поддержания уровня бодрствования, в том числе метаболические, тесно связанные с изменениями температуры тела и распределением парадоксальной фазы (ПФ) в течение сна, и гипоталамо-гипофизарная система (адрено-кортикотропная ось), обеспечивающая защитные стрессовые реакции, контролируются одним точным циркадианным метрономом. Все эти структуры филогенетически можно отнести к наиболее ранним протопатическим явлениям, а ПФ рассматривать как наиболее примитивный тип сна. Формирование у млекопитающих фазы медленноволнового сна (МС), развитие которого количественно зависело от предшествующего периода сна или бодрствования, имело прогрессивное регулирующее значение, поскольку обеспечивало достаточную гибкость и относительную (гомеостатическую) независимость от задающих ритм внешних влияний (Zeitgebers), в том числе смены дня и ночи. Поэтому циклическое чередование медленно- и быстроволновой фаз сна, по-видимому, явилось оптимальным эволюционным решением.
Вокруг циркадианного ритма существует строго упорядоченная иерархия ритмов с большей (инфрадианные) или меньшей (ультрадианные) периодичностью. Все они взаимосвязаны и синхронизированы между собой: высокочастотные колебания (даже на молекулярном и клеточном уровнях) генерируют низкочастотные, а низкочастотные выступают в качестве своеобразного счетчика и могут модулировать высокочастотные или запускать еще более низкочастотные (инфрадианные, например, эстрогенный цикл у женщин) колебания (Edmunds L.N., 1988). Циклическая организация сна хорошо иллюстрирует взаимодействие ритмических процессов разной частоты. Так, ультрадианная цикличность ПФ (90-100 мин.) четко контролируется циркадианным ритмом. Сама ультрадианная цикличность обеспечивается чередованием синхронизирующих и десинхронизирующих электрофизиологических процессов, которые в свою очередь состоят из смены электроэнцефалогрофических ритмов низкой (дельта-ритм) и высокой (альфа-ритм) частоты.
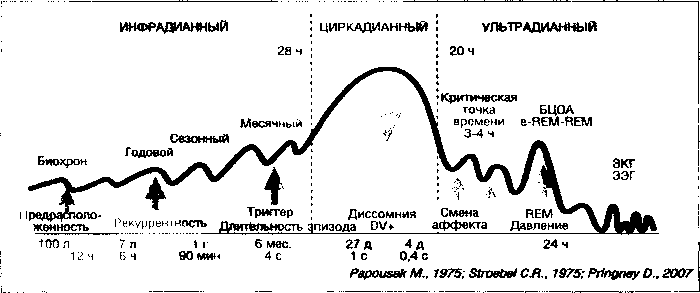
Для иллюстрации сказанного на рис. 2 мы представили сравнительную топологическую схему нормальных биоритмов и тенденции их изменения при депрессии. За основу была принята схема естественных биоритмов (Papousek М., 1975; Stroebel С. R., 1975). Инфрадианные ритмы, например, циркасептадианный (6-7 дней) (Вейн Ф. М., Хехт К., 1989 и др.) или месячный, эстрогенный также влияют на продолжительность и качество сна. Другим примером взаиморегуляции биоритмов разного уровня может служить исчезновение с достижением половозрелого возраста циркадианного ритма секреции половых гормонов (лютеинизирующего, фолликулостимулирующего и тестостерона) (Boyar R. et al., 1974 и др.).
Вся эта стройная пирамида обладает достаточной степенью прочности, устойчивостью и в то же время чувствительностью к воздействию внешних факторов. В норме изменение какого-либо ритма по типу обратной связи быстро приводит к его нормализации или подстройке других ритмов. Нарушение этих механизмов может вызвать серьезное патологическое состояние. Поэтому организация ритмических процессов в человеческом организме и их взаимодействие имеют первостепенное значение для понимания патогенетической сущности аффективных психозов. На рисунке 2 отчетливо видно, что большинство ритмических нарушений при аффективных расстройствах по частоте совпадает с естественными ритмами и по существу является их патологическим выражением, а часто и просто усилением их амплитуды. Это лишний раз подтверждает мысль, что болезнь часто является крайним вариантом нормы. Как следует из представленной схемы, основной хронобиологический механизм развития депрессии, по-видимому, связан с процессами, происходящими на уровне взаимодействия циркадианных ритмов с циклом сон-бодрствование. В последнее время, в частности, получила распространение гипотеза десинхронизации этих ритмов у больных с аффективными расстройствами. Подавление циркадианной ритмики при депрессии (десинхроноз) ведет к увеличению активности различных ультра и инфрадианных ритмов (нарис. 2 показано в виде вертикальных стрелок) (Pringney D., 2007). С точки зрения биоритмологии, фазовые проявления по сути представляют собой расстроенный инфрадианный ритм, тесно связанный с нарушениями других ритмических процессов практически всех важнейших функций организма и прежде всего сна. Другими словами, речь идет о тотальной десинхронизации стройной системы различных биоритмов. Приведем лишь несколько примеров из различных областей, подтверждающих этот тезис.
Клиницистам хорошо известна тесная связь аффективных колебаний с временем суток (ухудшение настроения утром и ранние пробуждения), временами года (сезонность) (Rosenthal N. Е. et al., 1983; Стрельник С. Н., 2006 и др.), феноменами быстрой цикличности (БЦ), в наиболее злокачественных случаях доходящей до двухсуточного или собственно суточного ритма (Jenner Е A. et al., 1968; Kupfer R, Heninger G., 1972; Sitaram N. et al., 1978; Von Zerssen D., 1983; Мосолов C.H., 1985 и др.). Менее известно, что пики сниженного настроения, нередко с суицидальными тенденциями, часто приходятся на первую четверть лунного цикла (27,5 дней) (Eastwood M.R., Whitton J.L., 1987), близкому к нему по периодичности менструальному циклу часто сопутствуют колебания психофизической активности и обострение аффективной симптоматики (Wehr Т. А., 1984). По-видимому, не случайно, что БЦ наиболее часто встречаются у женщин и могут быть спровоцированы применением половых гормонов типа эстрогена (Alarcon R.D.,1985), который в эксперименте у животных показал способность укорачивать циркадианные ритмы (Morin L. Р. et al., 1977).
У больных аффективными расстройствами также были обнаружены колебания настроения с сезонной (90 дней) периодичностью в 32% случаях, с месячной — в 20% и с недельной в — 5% (Eastwood М. R., Whitton J. L., 1987). Стрельник С.Н. (2006) считает, что хронопатология рецидивов эндогенных депрессий представлена многоуровневой иерархической временной организацией процесса рецидивирования, в которой принимают участие механизмы десинхроноза и патологической синхронизации макроритмов. Проведенный им клинико-хронобиологический анализ рецидивов эндогенных депрессий позволил классифицировать макроритмы с учетом длительности их периодов, роли в рецидивировании и преимущественной обусловленности (эндогенные, экзогенные) на следующие диапазоны:
- макроритмы с периодами 15-32 года — преимущественно эндогенные (клинико-онтогенетические);
- макроритмы с периодами 1-11 лет — экзогенные (экологические), в частности обусловленные ритмами солнечной активности;
- макроритмы с периодами 2-12 месяцев, обусловленные взаимосвязанными эндогенными («индивидуальный год» больного) и экзогенными (сезонность) факторами.
При этом хронотип рекуррентной депрессии или биполярного расстройства может меняться по мере течения заболевания с уменьшением доли многолетних кратных году и сезонных макроритмов и в увеличении доли некратных целому году (в среднем около 5,5 лет) и 3 месяцам, а также нарастании доли аритмических явлений в динамике заболевания (Стрельник С. Н., 2006).
О тесной связи аффективной симптоматики со смещением цикла сон-бодрствование свидетельствуют и статистические данные Jauhar, Weller (цит. Goodwin Е К., Jamison К. R., 1990), которые отметили у больных с биполярным расстройством при трансатлантическом перелете из США в Англию значительное увеличение числа обострений депрессивного полюса и, наоборот, при перелете с востока на запад — маниакальных обострений.
Помимо инфрадианных, при депрессиях расстраивается гармония цирка- и ультрадианных ритмов, в том числе 90-минутный ритм ПФ, а также температурный, нейроэндокринные, нейромедиаторные, электроэнцефалографические и другие биоритмы. Причем, для запуска процесса болезни достаточно минимальных нарушений в каком-либо одном звене, например, смещение фазы ритма, небольшое изменение его периода или амплитуды. С каждым новым витком рассогласование с ближайшим по частоте (соседним) ритмом постепенно возрастает до тех пор, пока ритм не попадает в противофазу или резонанс. В первом случае ритмы взаимно подавляются и развивается угнетение, во втором, наоборот, взаимно потенцируются и развивается возбуждение. При этом от степени первичного смещения между ритмами зависит частота цикличности заболевания. Экспериментально этот механизм был доказан Reinberg А., Halberg Е (1971) и называется «beat-феноменом» (Goodwin Е. К., Jamison К. R.,1990). Понятно, что он может развиваться в любой функциональной системе организма и с биоритмами любого уровня. Так, была показана возможность его развития между циркадианными ритмами норадреналина и дофамина при манипуляциях с бета-гидроксилазой, ферментом, превращающим дофамин в норадреналин (Goodwin Е К., Jamison К. R., 1990).
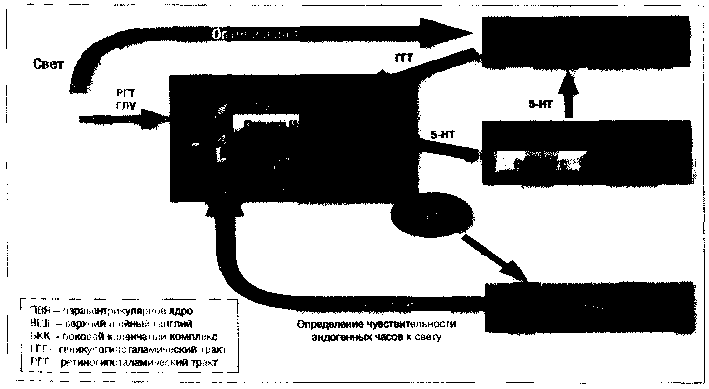
В норме морфология и физиология центральной синхронизации циркадианных ритмов и цикла сон-бодрствование выглядит следующим образом (рис. 3) (Turek F. W. et at., 2001; Richardson G. S., 2005).
Циркадианные ритмы млекопитающих регулируются центральными биологическими часами (главный пейсмейкер), расположенными в парных СХЯ в переднем гипоталамусе, содержащих около 20000 клеток. Ядро задает эндогенный биологический ритм, близкий к 24 часам, по всему организму. Этот ритм все время подвергается коррекции (синхронизируется) различными факторами внешней среды, преимущественно сменой дня и ночи. Фото сигналы передаются в мозг посредством 2 зрительных путей: ретиногипоталамического тракта (РГТ), который осуществляет прямую связь между сетчаткой и СХЯ, и непрямого пути от сетчатки через оптический тракт к боковому коленчатому комплексу, от которого через геникулогипоталамический тракт (ГГТ) осуществляется связь с СХЯ. Несветовое модулирующее влияние на СХЯ осуществляется из серотонинового медианного ядра шва также двумя путями: прямым восходящим пучком к СХЯ и опосредованным влиянием через интергеникулярную прослойку. Через ПВЯ возбуждение СХЯ стимулирует выработку гормона мелатонина в эпифизе.
Мелатонин сам по себе не определяет циркадианный ритм, а оказывает модулирующее влияние на него, смещая фазу ритма (ее начало и длительность) через воздействие на МТ1 рецепторы в СХЯ (Weil Z. М. et al., 2006), и устанавливая чувствительность эндогенных часов к свету, т.е. фактически играет роль их маятника. Высвобождение мелатонина начинается ранним вечером и является наиболее надежным биологическим маркером периодичности циркадианных ритмов. Стимуляция МТ2 рецепторов играет ингибирующую роль в СХЯ (их блокада в эксперименте у животных вызывает депрессивноподобное поведение и снижает амплитуду ритмов). Серотониновое влияние на СХЯ также играет модулирующую ограничительную роль. В СХЯ обильно присутствуют 5-НТ2С рецепторы, которые, как известно, принимают участие в регуляции МС (их блокада усиливает дельта-волновую активность, а стимуляция вызывает светоподобный эффект на циркадианные ритмы) (Kennaway D.J., Hoyer R. W., 1998).
В настоящее время известно 3 подтипа мелатонинергических рецепторов, наиболее хорошо изучена структура, функция и локализация в ЦНС первых двух — МТ1 и МТ2 (рис. 4).
Как видно из схемы, оба подтипа представлены достаточно широко в различных структурах мозга, включая гиппокамп и кору, что, по-видимому, отражает широкое влияние циркадианных ритмов на все психические функции (Pandi-Perumal S. R. et al, 2008). Точная физиологическая роль этих, связанных с G-протеином, рецепторов до конца не известна, причем в зависимости от соотношения их представленности в различных структурах мозга эффекты мелатонина проявляются по-разному. Например, это соотношение меняется при нейродегенеративных процессах, включая болезнь Альцгеймера, и при длительном применении антидепрессантов (Brunner Р. et al., 2006; Hirsch-Rodriguez Е. et al., 2007; Pandi-Perumal S. R. et al., 2008).
Аффинитет мелатонина к рецепторам 3 подтипа существенно ниже, и физиологическое значение этих рецепторов не ясно (Spadoni G., Bedini А., 2007). Нейрогормон мелатонин вырабатывается в эпифизе, сетчатке и кишечнике, его содержания в плазме крови человека ночью в 2-4 раза выше, чем днем, поэтому иногда его называют «гормоном ночи или тьмы» (Wright К. R., Rogers N.J., 2007). Помимо ускорения засыпания и нормализации структуры цикла «сон-бодрствование», мелатонин оказывает множество других биологических эффектов: гипотермический, антиоксидантный, противораковый, адаптогенный, синхронизационный, которые в целом можно определить как гомеостатическую регуляцию. Его выработка снижается в процессе старения организма. При депрессии отмечается нарушение суточного выброса мелатонина, включая уплощение ночного пика (Germain A.,Kupfer D.J., 2008).
Основные лечебные психотропные свойства мелатонина, по-видимому, связаны с:
- модуляцией функции эмоциогенных лимбических структур головного мозга через изменение нейромедиаторных процессов,
- синхронизацией циркадианной ритмики за счет сопряженных отношений с СХЯ гипоталамуса,
- устранением нейротоксичности различных факторов, повреждающих деятельность центральных нейронов (свободных радикалов, глутамата, окиса азота и др.).
Собственно антидепрессивным действием экзогенный мелатонин не обладает (Carman J. S. et al., 1976), хотя в экспериментальных моделях у мышей его введение предотвращало развитие явлений хронического стресса (Корр С. et al., 1999), и добавление его в схему лечения у депрессивных больных улучшало исходы (Hirsch-Rodriguez Е. et al., 2006; Wirz-Justice А., 2009).
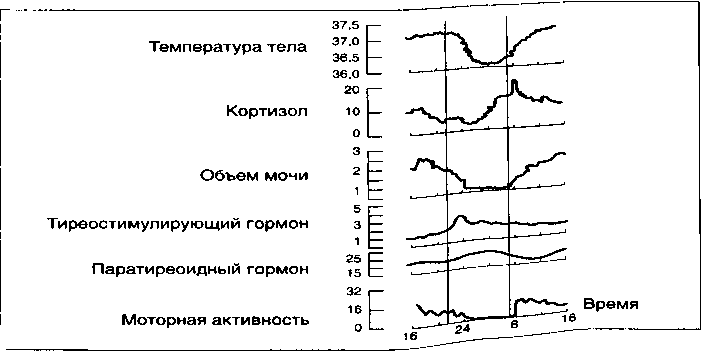
В норме многие биологические показатели организма (температура тела, артериальное давление, различные вегетативные параметры, уровень кальция, секреция некоторых гормонов, объем выделяемой мочи, моторная активность и др.) изменяются в соответствии с суточным ритмом (см. рис. 5) (Parker D. et al., 1981; Pflug В. et al., 1981; Вейн A.M., Хехт К., 1989; Яровицкий В. Б., 1993, Czeisler С. А. et al., 2005 и др.).
Засыпание, например, в нормальных условиях происходит одновременно со снижением температуры тела, а просыпание с ее подъемом. Циркадианный минимум температуры приходится на 5 часов утра, а максимум на 5 часов вечера. В период МС температура тела падает, но терморегуляция поддерживается; в период ПФ гомеостатические функции утрачиваются, температура, несмотря на отсутствие терморегуляции, несколько повышается, т.е. ПФ обладает так называемыми пойкилотермными свойствами (Parmeggian Р, 1982; Foret J. et al., 1985).
Аналогичному никтогемеральному профилю подчиняется и большинство нейроэндокринных параметров, которые участвуют в патогенезе депрессии (Mendlewicz J., 1982; Akerstedt Т., 1984).Так, пик секреции пролактина всегда приходится на период засыпания и, постепенно, замедляясь, достигает своего минимума к полудню (Van Cauter Е. et al., 1981). Parker D. и соавт. (1981) показали, что секреция пролактина усиливается в период МС и подавляется в ПФ. Секреция соматотропного гормона более жестко связана с началом МС, что свидетельствует о его анаболической (восстанавливающей силы организма) функции. Максимальная секреция кортизола приходится на период пробуждения (ранние утренние часы), затем она постепенно понижается и особенно низкого уровня достигает в период засыпания. Подмечено, что наибольшая кортизоловая активность наблюдается в конце ночи, когда преобладает ПФ сна (Benoit G., 1984). Секреция тиреотропного гормона и АКТГ в процессе сна резко снижается (Akerstedt Т, 1984). Во время сна происходит снижение экскреции натрия, калия, хлоридов и кальция, а также большинства метаболитов нейромедиаторов мозга, изменяется плотность нейрорецепторов на мембране, концентрация таких нейропептидов, как субстанция Р и соматостатин в супраоптическом ядре мозга (Wirz-Justice А., 1983; Souetre Е. et al., 1989; Вейн А. М., Хехт К. и др., 1989; Azorin J. М., Kaladjian А., 2009). Не исключено, что циркадианные колебания присутствуют также на клеточном и высокомолекулярном (белковом) уровнях. Другими словами вся деятельность центральной нервной системе (ЦНС) пронизана циркадианной периодичностью.
Между тем, цикл сон-бодроствование и другие циркадианные ритмы, например, температурные, не связаны прямо и подчиняются различным внутренним осцилляторам (водителям ритма). Это подтверждается, в частности, десинхронизацией ритмов, которая обнаруживается при изоляции от внешних факторов: температурный ритм как более стабильный остается циркадианным, цикл сон-бодрствование меняется — появляются короткие и длинные дни. В дальнейшем было показано, что длительность последнего регулируется гомеостатически и зависит, в частности, от выработки эпифизарного гормона -мелатонина (Wever R. А., 1979; Lund R., 1989; Rusak В., Zucker I., 1979), а взаимодействие его с циркадианным ритмом определяется сложным многоуровневым процессом (Borbely А. А., 1982; Daan et al., 1984).
В настоящее время преобладает мнение, что температура тела, плотность и особенно распределение в течение сна ПФ, секреция кортизола, уровень экскреции калия и ряд других важнейших биохимических процессов, в том числе нейромедиаторных, ответственных за мыслительную и психомоторную активность, регулируются сильным циркадианным осциллятором (X), практически не зависящим от влияний внешней среды. Более слабый осциллятор (Y), реагирующий на изменения внешней среды и прежде всего на смену дня и ночи, регулирует цикл сон-бодрствование, отдых-активность и ряд связанных с ними нейроэндокринных параметров (Kronauer R., 1982).
Кроме того, помимо центрального водителя ритма или, так называемых, главных часов организма, расположенных в СХЯ, существует множество относительно независимых центральных (дыхательный, сосудодвигательный, другие гипоталамические секреторные центры) и периферических ритмов (например, мышечный тонус, сокращение желудка и желчного пузыря, продукция пищеварительных ферментов и др.), согласующихся с внешними Zeitgebers (например, двигательная активность, прием пищи, социальные факторы), и их десихронизация с центральными часами является фактором риска для развития различных психических и соматических расстройств (Stubbe J. Н., van Dijk G., 2002 и др.). Дисфункция биологических часов, связанная с изменением хронотипа, может быть первичной, если причиной являются внутренние (эндогенные) механизмы и вторичной, если сдвиг вызван внешними факторами окружающей среды. В любом случае изменения хронотипа могут иметь неблагоприятные последствия для физического или психического здоровья.
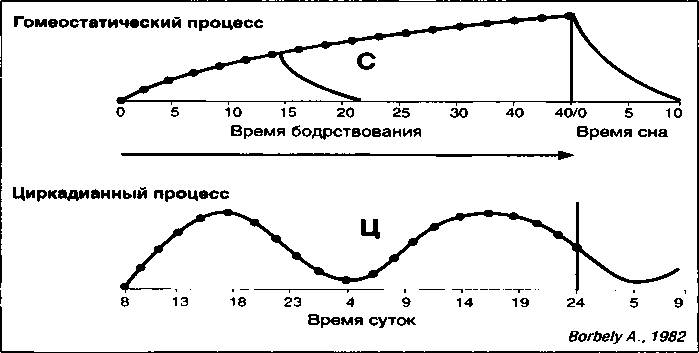
В соответствии с получившей наибольшее распространение в мире схемой Borbely А. А. (1982) сон регулируется двумя находящимися в реципрокных отношениях процессами (рис. 6).
Первый из них, процесс Ц, контролируется сильным Х-осциллятором, ритмическая активность которого мало зависит от внешних влияний и интимно связана с гипоталамо-гипофизарно-адреналовой осью. Второй, процесс С, регулируется гомеостатически, т.е. более подвержен влиянию факторов внешней среды и, возможно, целиком регулируется одним гипоталамическим нейропептидом, при достижении критической концентрации которого в крови (примерно через 2 суток) неизбежно наступает сон (Ursin R., 1984; Kupfer D., 1989). Именно этот процесс, эволюционно несущий адаптивную функцию, играет важную роль в формировании резерва компенсаторных возможностей по стабилизации биоритмической организации, поскольку сдерживает активность процесса Ц и гасит чрезмерный размах его колебаний.
При аффективных расстройствах эндогеноморфная генетическая предиспозиция1 и разнообразные преморбидные факторы формируют нейробиологический субстрат, который фенотипически проявляется в неустойчивости биоритмической структуры организма и отражает снижение его компенсаторных возможностей по ресинхронизации системы. Другими словами, биоритмическая среда недостаточно инертна, чтобы быстро гасить естественно увеличивающуюся в ответ на какие-либо внешние воздействия амплитуду колебаний того или иного ритма.
Недостаточность процесса С является предпосылкой для развития заболевания. В этих условиях повторные социально-психологические стрессовые воздействия по известной схеме Селье через гипоталамо-гипофизарно-адреналовую систему, в том числе усиление утренних выбросов глюкокортикоидов (Post R.N., Weiss S.R., 1989) и кортикотропный релизинг-фактор (Nemeroff С. В., 1989), активизируют процесс Ц, который не возвращается полностью в исходное положение, как в норме. Остаточное усиление амплитуды колебаний и небольшие смещения ритмов постепенно суммируются до тех пор, пока компенсаторный резерв процесса С не истощается, что выражается в их десинхронизации, резком смещении циркадианных ритмов на более раннее время суток (опережение фазы). Клинически это проявляется в виде развития первой ситуационно-мотивированной субдепрессии или депрессии умеренной тяжести с типичным циркадианно-витальным симптомокомплексом (утренними ухудшениями настроения, витальными ощущениями и ранними пробуждениями) и соответствующей циклотимоморфной картиной полисомнографических нарушений. Рассогласование в центральном (циркадианном) звене биоритмической организации быстро распространяется на всю систему, то есть на инфрадианные и ультрадианные ритмы. Однако на начальных этапах заболевания инертность «маятника» биологических часов и внутренние саногенные десинхронизирующие тенденции достаточно велики, чтобы сбалансировать ритмические структуры различных уровней.
Повторное развитие фазовых проявлений в целом происходит по такому же сценарию, но значительно облегчается по хорошо известным в условно-рефлекторной физиологии следовым механизмам и в связи с прогрессивным уменьшением компенсаторных возможностей системы. Кроме того, первичная десинхронизация ритмов сама по себе приводит к снижению уровня адаптации больного, к плохой приспособляемости к внешним Zeitgebers, в том числе социальным (Ehlers С. L. et al., 1993), что усиливает сенсибилизацию к стрессовым воздействиям и создает дополнительные возможности для развития аффективной симптоматики.
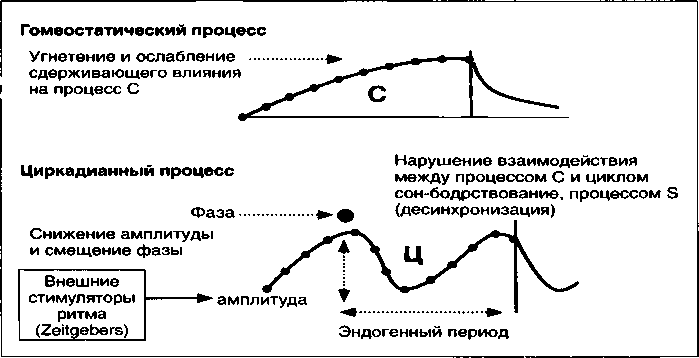
При повторных депрессиях отмечается отчетливое угнетение процесса С и ослабление его сдерживающего влияния на процесс Ц (Borbely А. А., 1987). Наблюдается снижение его чувствительности к воздействию внешних стимуляторов ритма.
В том числе к смене дня и ночи, что сопровождается снижением амплитуды циркадианных ритмов и смещением акрофазы на более раннее время суток (рис. 7).
В недавнем исследовании Emens J. с соавт. (2009) было показано, что тяжесть депрессии коррелирует со сдвигом фазы продукции мелатонина (рис. 8).
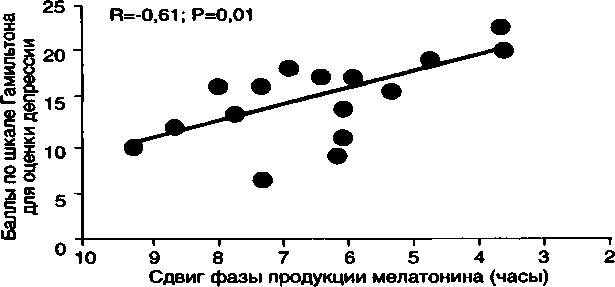
Рис. 8. Тяжесть депрессии коррелирует с дисрегуляцией циркадианных ритмов (адаптировано по Emers J. et al., 2009)
Сдвиг фазы — интервал между началом выработки мелатонина в сумерках (10 pg/ml) и серединой сна
При этом чаще наблюдается задержка фазы (Wirz-Justice А., 2008). Другими словами наступает десинхронизация циркадианного ритма с никтогемеральным циклом. Интересно, что сбой социальных водителей ритма (Social zeitgebers) также может быть одним из механизмов запуска депрессии (Ehlers С. L. et al., 1993; Malkoff-Schwartz S. et al., 1998). Предложена даже специальная психотерапевтическая и психосоциальная методика для предотвращения этого феномена (Frank Е. et al., 2000).
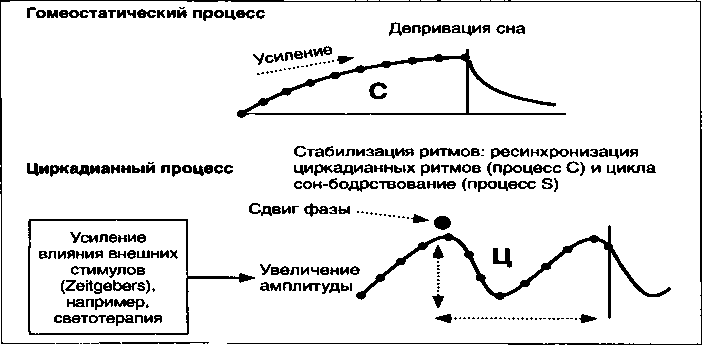
Существует по крайней мере два, хорошо известных из клинической практики, эффективных метода хронобиологической коррекции этого десинхроноза при депрессиях. Первый — это депривация сна, активирующая процесс С, и второй — это фототерапия, т.е. воздействие ярким белым светом на сетчатку глаза, позволяющая искусственно сместить фазу и увеличить амплитуду колебаний циркадианного осциллятора (рис. 9) (Wirz-Justice A., Van den Hoofdakker R. H., 1999; Terman H., TermanJ.S., 2005).
При этом главное лечебное действие и даже возможность инверсии фазы при депривации сна зависит не столько от общего времени, проведенного без сна, сколько от бодрствования во второй половине ночи (Schilgen В., Tolle R., 1980) или даже от смещения нормального периода сна на 6 часов вперед (Wehr Т. A. et al., 1979; Sack D. A. et al., 1985). Большинство исследователей терапевтический эффект депривации сна объясняет задержкой цикла и ресинхронизацией ритмов (Rudolf G., Tolle R., 1978; Вовин З.Я., Фактурович Ф.Я., 1985; Айрапетов Р. Г., 1987). Более того, Beersma D. G. с соавт. (1989) показали, что такой распространенный при меланхолической депрессии феномен, как типичные суточные колебания настроения, также непосредственно связан с ритмом сон-бодрствование и поддается коррекции депривацией сна.
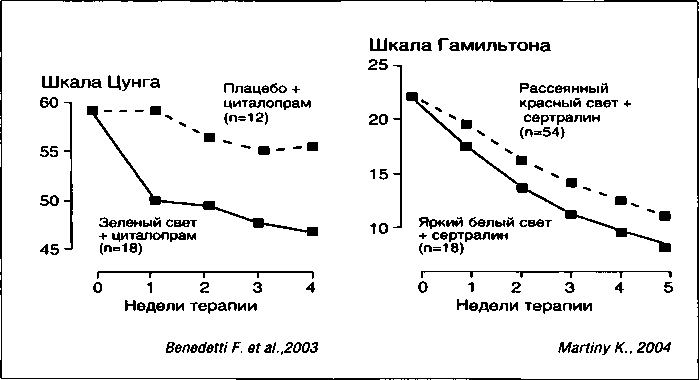
Близким механизмом действия при депрессиях, по-видимому, обладает терапия ярким белым светом (Kripke D. F. et al., 1983; Rosenthal N. E. et al., 1985 и др.) (рис. 10).
Эффективность фототерапии показана при сезонном аффективном расстройстве, послеродовых депрессиях, предменструальных и меланхолических депрессиях (Benedetti Е et al., 2003; Marting К., 2004; Golden R.N. et al., 2005).
Доказано, что при депрессии нарушаются многие биологические ритмы (рис. 11).
В частности, происходит снижение амплитуды выброса кортизола, тиреостимулирующего гормона, мелатонина, числа сердечных сокращений, температуры тела, серотонина и др. (Wehr Т.А., 1977; Kripke D. F. et al., 1978; Pflug B. et al, 1981; Schultz H„ Lund R., 1983; Duncan W. C., 1996). Заинтересованность серотонинергических механизмов в хронобиологическом механизме развития депрессии косвенно подтверждают высокая концентрация серотонина и высокая плотность 5-НТ2С-рецепторов в СХЯ.
Почти 90% депрессивных больных в том или ином виде предъявляют жалобы на расстройства сна и около 20% больных с нарушениями сна страдают депрессией. Нарушения сна часто предшествуют развитию депрессивного эпизода, являются «сигнальным» симптомом и основным поводом обращения к врачу. Суицидальные мысли тесно связаны с плохим качеством сна. Нарушения сна нередко остаются после разрешения основных симптомов депрессии. Несмотря на то, что ранние пробуждения, ухудшение настроения и витальные переживания по утрам (типичная суточная ритмика) являются наиболее характерными признаками типичной меланхолической депрессии, при депрессии очень часто нарушены засыпание и непрерывность сна (пробуждения в течение ночи), отмечаются сокращение общей продолжительности сна, низкая эффективность сна, ночные кошмары, а днем наблюдаются снижение уровня бодрствования и функционирования, сонливость, клинофилия и агрипногнозия. Другими словами, по меткому выражению одного из ведущих французских сомнологов Lemoine Р. (2007), «бессонница и депрессия представляют собой два клинических варианта одного и того же генетически обусловленного хронопатологического паттерна».
Хорошо известно, что именно расстройства цикла сон-бодрствование занимают одно из ведущих мест при депрессии. И это связано не только с собственно нарушениями сна, на циклической структуре которых мы остановимся ниже, но прежде всего с определенной поломкой центральных механизмов, регулирующих целостные процессы психофизиологической ритмики в организме (Wehr Т. А., Goodwin F.K., 1983). Помимо характерной циркадианной организации психопатологической симптоматики депрессии с ухудшением состояния утром и улучшением к вечеру, можно думать, что сами фазовые колебания являются расстроенным инфрадианным ритмом. Это, в частности, подтверждается существованием давно подмеченной сезонности аффективных нарушений (Rosenthal N. et al., 1983; Lacoste R., Wirz-Justice A., 1989) и особенно явственно обнаруживается при континуальном течении или феномене «быстрой цикличности» (БЦ), доходящей в наиболее злокачественных случаях до собственно суточного ритма. Более того, Kupfer D., Heninger G. (1972) и Sitaram N. с соавт. (1978) показали, что у больных с 48-часо-вым аффективным циклом периоды активности ПФ сна совпадают с дневной гипоманией, а сама инверсия фазы тесно связана с циркадианными ритмами.
В качестве гипотезы, объясняющей развитие депрессии, Papousek М. (1975) выдвинул теорию фазового опережения циркадианных ритмов, которая в последующем нашла подтверждение в ряде клинических исследований. В частности, обнаруживается десинхронизация ритма сон-бодрствование и температурного циркадианного ритма, а при полисомнографическом исследовании укорочение латентного периода ПФ сна (ЛПФ), т.е. смещение ее развития на более раннее время суток. Смещение фазы продукции мелатонина в течение ночи коррелирует с выраженностью депрессии (Emens J. et al., 2009) (рис. 8). Аналогичные изменения происходят в эксперименте у здоровых добровольцев при сенсорно-информационной депривации (Lund R., 1989). На этом основании ряд исследователей выдвинул гипотезу о нарушении у больных депрессией центрального механизма, синхронизирующего циркадианные ритмические процессы, что проявляется в своеобразной невосприимчивости к имеющим важное регулирующее значение факторам, таким как смена дня и ночи (Mendlewicz J., 1982; Wehr T, Goodwin Е К., 1983).
Как известно, сон представляет собой сложный нейрофизиологический феномен, интегрированный в циркадианный ритм. Являясь местом взаимодействия ультра-, цирка- и инфрадианных ритмов, сон служит идеальной моделью для изучения хронобиологических нарушений при аффективных расстройствах.
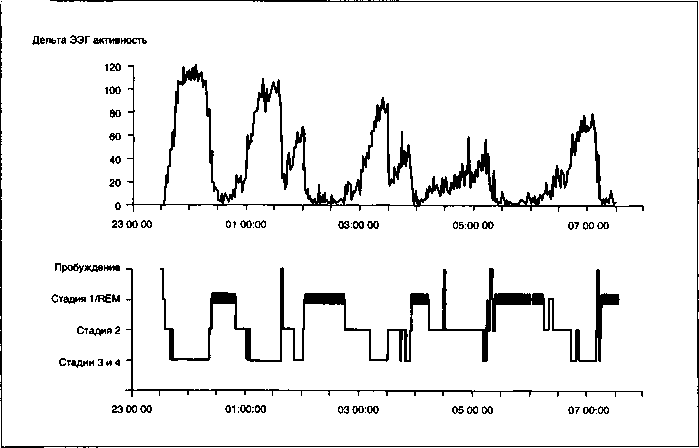
Помимо циркадианного ритма, в сложном циклическом феномене сна выделяют также непосредственно связанный с ним ультрадианный ритм, обусловленный последовательными сменами медленноволновой и парадоксальной фаз сна. В отличие от 3 и 4 стадии сна, в которых преобладают медленноволновая активность или дельта-ритм, в ПФ мозг фактически находится в состоянии «обездвиженного бодрствования», а окулография выявляет быстрые движения глазных яблок, так называемый REM-сон. Считается, что во время ПФ происходят процессы психической адаптации и создание программы поведения, а МС выполняет гомеостатическую (восстановительную) и анаболическую функции, а также оптимизацию управления внутренними органами. Позитронно-эмиссионная томография показывает, что в период REM фазы происходит активация ретикулярной формации ствола головного мозга, лимбических и паралимбических структур и участков коры, ответственных за исполнительские функции (Nofzinger et al., 2004). У здорового человека возникновению ПФ всегда предшествует МС (рис. 12).
Вместе они образуют циклы, длительность которых в течение ночи достаточно постоянна и составляет от 90 до 100 минут. В норме за 1 ночь наблюдается от 4 до 6 подобных циклов, причем длительность ПФ в течение сна постепенно возрастает (Rechtschaffen А., Kales А. А., 1968; Benoit D., 1984; Вейн А. М., Хехт К., 1989 и др.). Важно, что плотность и распределение в течение сна ПФ показатель достаточно постоянный и коррелирует со стабильными циркадианными ритмами. Длительность МС является более гибким гомеостатическим показателем и прямо зависит от времени бодрствования перед сном (Benoit D., 1984; Goodwin F. К., Jamison К. R., 1990). Представленность дельта активности падает от цикла к циклу в течение ночи (рис. 12). Парадоксальная и медленноволновая фазы сна находятся в реципрокных отношениях: увеличение плотности и длительности одной, приводит к подавлению (уменьшению представленности) другой, что в соответствии с гипотезой A. A. Borbely отражает взаимоотношение двух процессов Ц и С. Наиболее важным показателем, отражающим состояние всего сна в целом, является соотношение основных фаз сна в первых двух циклах, т. е. фактически представляет собой матрицу ультрадианного распределения ЭЭГ-ритмов в течение ночи. В норме основная медленноволновая активность приходится на 1-й цикл, в конце которого развивается короткая ПФ. Во 2-м и последующих циклах постепенно сокращается активность МС и нарастает активность ПФ.
На длительность и структуру сна влияют и другие эндогенные ритмы, которым, в частности, подчиняется выработка центральных нейромедиаторов. На этом основании R. McCarley и Т. A. Hobson предложили гипотезу холинергического и норадренергического баланса циклической регуляции сна. Было показано, что холинергические агонисты типа ареколина или ингибиторы холинэстеразы типа физостигмина способны несколько увеличивать плотность ПФ и сокращать латентный период ее наступления, в то время как холинергические антагонисты типа скополамина действуют в противоположном направлении (Gillin J. С., Sitaram N., 1984). Другими словами, в период ПФ сна происходит подавление активности норадренергических и стимуляция холинергических нейронов. В последние годы были также выделены новые специфические гипоталамические нейропептиды орексин и гипокретин, регурирующие никтогемеральный цикл. Нейроны, содержащие гипокретин, локализуются в дорзальном и латеральном отделах гипоталамуса и проецируются практически во все отделы мозга, включая норадренергическую систему голубого пятна. Гипокретин обладает активирующими эффектами, участвует в регуляции цикла «сон-бодроствование», пищевого поведения, эндокринных функций и сердечно-сосудистой деятельности. Орексин повышает локомоторную активность, модулирует ряд нейроэндокринных функций и фактически выполняет роль переключателя функций сна и бодрствования, предотвращая развитие промежуточных состояний (Draganski В. et al., 2002). Показано, что система орексин/гипокретин определяет момент развития ПФ сна, и нарушение ее функционирования, в частности снижение продукции орексина, приводит к внезапному возникновению ПФ во время бодрствования у больных нарколепсией (Hajak G. et al., 2003).
Полисомнографические исследования позволили достаточно точно определить характеристику нарушений сна у депрессивных больных. К сожалению, большинство исследователей не различало больных с уни- и биполярным течением. Накопленные литературные данные свидетельствуют о том, что при депрессиях наблюдается достаточно однородная и устойчивая полиграфическая картина нарушений сна.
Kupfer D. (1981) выделил 4 основных полисомнографических критерия первичной или эндогенной депрессии:
- укорочение ЛПФ менее 60 минут (т.е. сокращение времени достижения первого эпизода ПФ сна);
- укорочение времени дельта-ритма или МС, т.е. уменьшение или даже полное исчезновение 3-й и 4-й стадии сна;
- увеличение частоты глазных движений в период ПФ (т. е. плотности ПФ), особенно в первых циклах сна;
- нарушение непрерывности сна (частые пробуждения), снижение его эффективности.
Кроме того, было отмечено, что происходит перераспределение ПФ в течение ночи с ее смещением на первую половину сна (короче ЛПФ и длиннее первая ПФ) (Duncan W.C. et al., 1979; Kupfer D.J.,1989). При этом МС в первом цикле практически полностью исчезает и перемещается во второй цикл (McCarley R. W., 1982; Giles D. Е. et al., 1986).
Хотя все эти критерии эндогенной депрессии в основном были подтверждены и в других многочисленных работах (Gillin J. С. et al., 1979; Vogel G. W. et al., 1980; Feinberg M. et al., 1982 и др.), нужно отметить, что они не являются абсолютно специфичными и могут наблюдаться при депрессивных состояниях экзогенной природы (Kupfer D.J., 1976; Duncan W. С. et al., 1979; Karacan I., Bertelson A. D., 1980). Более того, при некоторых вариантах депрессии, сопровождающихся анергией и гиперсомнией показатели непрерывности сна могут быть нормальными.
Главным методологическим недостатком проведенных полисомнографических исследований необходимо признать отсутствие клинической синдромальной дифференциации депрессий. В большинстве случаев речь, по-видимому, идет о типичном варианте меланхолической депрессии. Это подтверждается единичными отечественными исследованиями (Вейн А. М., Айрапетов Р. Г., 1984; Айрапетов Р. Г., 1987), которые аналогичные изменения обнаружили в основном при тоскливой депрессии.
По данным современной литературы следует, что наиболее устойчивым показателем при депрессии является укорочение ЛПФ. При этом увеличение активности ПФ наиболее ярко обнаруживается в первой половине ночи, а частые пробуждения — во второй половине (Von Zezssen D., 1987). Длительность ПФ не коррелирует прямо с числом пробуждений и временем дельтаволнового сна (Kupfer D.J., 1976; Gillin J. С. et al., 1979; Akiskal H.S. et al., 1982; Reynolds C.E et al., 1982; Giles D. E. et al., 1986; Nutt D. et al., 2008). По мере редукции депрессии увеличивается и ЛПФ, однако у большинства больных он не возвращается полностью к норме и сохраняется в ремиссии (Coble P.A. et al., 1979; Kupfer D.J., 1982; Thase M. E. et al., 1998). Другие полисомнографические показатели имеют тенденцию к постепенной полной нормализации (Hauri Р. et al., 1974; Rush et al., 1986).
Отечественные исследователи Шульга А. И. и Сонник Г.Т. (1987) также подтвердили сдвиг ряда циркадианных ритмов у депрессивных больных с первых часов бодрствования на последние часы сна. При этом дифференцированное применение трициклических антидепрессантов (мелипрамина или амитриптилина) в различное время суток и в зависимости от синдромального варианта (тревожный или меланхолический) оказывало быстрый (8-10-й день лечения) терапевтический эффект в 89,7% случаев.
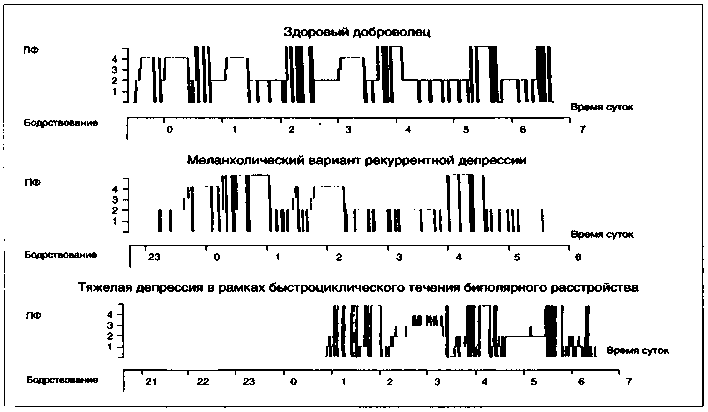
Наши собственные полисомнографические исследования у депрессивных больных в целом подтвердили литературные сведения (Мосолов С. Н., 1992). На рисунке 13 представлены несколько типичных гипнограмм больных рекуррентной и биполярной депрессией.
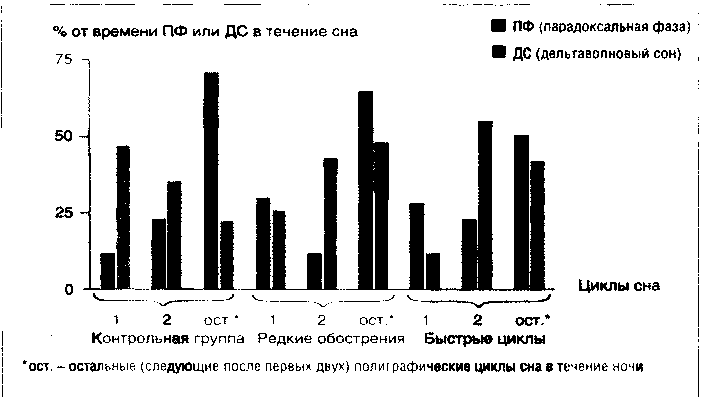
В целом эти данные при биполярной депрессии по группам больных с редкими и частыми обострениями по сравнению с контрольной группой обобщены на рисунке 14.
Видно, что соотношения представленности ПФ и МС в первом цикле меняется на противоположное при развитии депрессивной фазы, а большая часть дельтаволновой активности из первого цикла смещается во второй. При этом меняется все ультрадианное распределение основных фаз сна в течение ночи: активность (плотность и длительность) ПФ резко усиливается в первую половину ночи и даже в первые часы сна. Особенно отчетливо этот феномен прослеживается при тяжелых депрессиях и быстроциклическом течении (см. гипнограмму № 3 на рис. 14). Видно, что больной долгое время не мог заснуть, а затем после коротких 1 и 2 стадий сна и при полном отсутствии 3 и 4 стадий сразу как бы «провалился» в парадоксальный сон, который был весьма разорванным. МС полностью переместился во второй цикл. В этом же исследовании нами были показаны хронобиотические свойства солей лития и некоторых антиконвульсантов (Мосолов С. Н., 1992).
Влияние на полисомнографическую картину сна у депрессивных больных тимоаналептических средств изучено достаточно хорошо (см. рис. 15).
В настоящем обзоре нам представляется важным остановиться на данных, указывающих на воздействие антидепрессантов на ПФ и особенно на ее латентный период и распределение в течение ночи. Поскольку, как следует из приведенных выше сведений, именно два последних параметра являются частой находкой при депрессиях и напрямую связаны с циркадианной ритмикой.
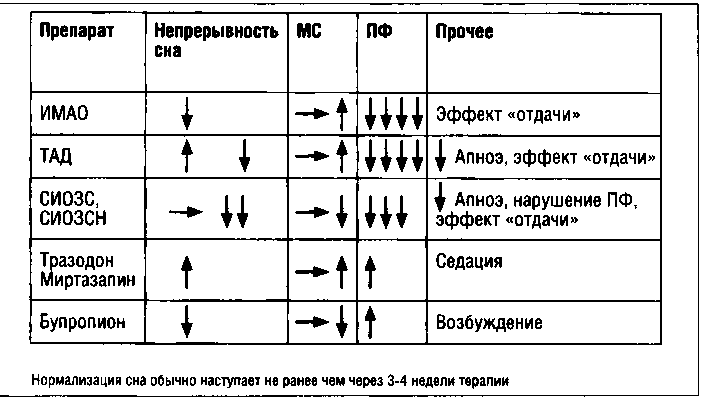
лассические трициклические антидепрессанты (ТАД) (амитриптилин, кломипрамин, имипрамин) с первого дня терапии вызывают увеличение ЛПФ, уменьшение более чем на треть длительности ПФ и эффект «отдачи», т.е. увеличение продолжительности ПФ на 100-150% после отмены препарата. Длительное (более 1 месяца) применение препарата вызывает развитие толерантности и постепенное исчезновение указанных эффектов (Kupfer D. et al., 1974; Lacey J. H. et al, 1977; Gillin J. C. et al., 1979; Gaillard J. M., 1984). Сила подавления ПФ трициклическими антидепрессантами, по-видимому, зависит от их холинолитических свойств и прямо коррелирует с концентрацией в плазме и периодом полужизни (Hill S. Y. et al., 1980; Kupfer D.J., 1981).
В отличие от ТАД ингибиторы МАО (ИМАО) подавляют ПФ сна через несколько дней терапии, а эффект «отдачи» наблюдается только к 10 дню отмены препарата, снижается непрерывность и эффективность сна (Cramer Н., Kuhlo W., 1967; Gift Т. Е. et al., 1980).
Большинство селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата норадреналина (СИОЗСН) также сокращают длительность ПФ, хотя и могут отличаться по воздействию на собственно архитектуру сна (Wirz-Justice А., 1983; Kupfer.J. et al., 1987; Armitage R., 2000, 2007). Тразодон, миртазапин и бупропион могут усиливать активность ПФ, причем бупропион нарушает непрерывность сна.
Увеличение ЛПФ и сокращение длительности ПФ в первые два дня лечения могут служить предикторами терапевтического эффекта антидепрессанта (Gillin J. С. et al., 1979; Hochli D. et al., 1986; Kupfer D.J. et al., 1987 и др.).
Уникальное влияние на архитектуру сна оказывает новый антидепрессант агомелатин, который является агонистом мелатонинергических рецепторов 1 и 2 типов и антагонистом 5-НТ2С-рецепторов. Агомелатин восстанавливал нарушенные циркадианные ритмы во всех моделях у животных, включая задержку или опережение фазы (Armstrong S. М. et al., 1993; Martinet L. et al., 1996), т.е. оказывал истинное хронобиотическое действие. У больных депрессией агомелатин восстанавливал нормальную архитектуру сна и ультрадинное распределение основных фаз в течение ночи. При этом активность ПФ смещалась на вторую половину ночи (3-й цикл), а представленность МС резко возрастала в первом цикле (Quera Salva М. A. et al., 2007). В отличие от сертралина агомелатин у больных депрессией улучшал сон уже через неделю терапии (Kasper S. et al., 2008).
Таким образом, хронобиологические механизмы, в частности, десинхронизация циркадианного ритма с циклом сон-бодрствование, играют важную роль в патогенезе депрессии и аффективных расстройств в целом. Учет этих механизмов и применение современных лекарственных средств с хронобиотическими свойствами может существенно повысить эффективность терапии таких больных.