РДР является хроническим, дезадаптирующим заболеванием, характеризующимся депрессивными эпизодами, которые часто сопровождаются нарушениями поведения, познавательной сферы и сферы восприятия. Эти расстройства, как правило, полностью редуцируются в периоды ремиссий, и степень социальной дезадаптации пациентов определяется частотой, длительностью и тяжестью развивающихся у них рецидивов депрессивной симптоматики. Больные РДР относятся к контингенту наиболее «сохранных» страдающих психическими расстройствами пациентов. Высокая распространенность РДР, а также многочисленные проблемы, связанные с ущербом, наносимым этим заболеванием, определяют высокий интерес специалистов к новым возможностям в области терапии депрессии. Встречаемость РДР в популяции среди мужчин составляет 6%, среди женщин — 15%. Риск заболевания в течение жизни составляет около 20% (Costa е Silva J. А., 1993; Tylee А., 2000).
Начало нозологическому пониманию расстройств депрессивного спектра положил основоположник современной психиатрии Эмиль Крепелин. Он объединил все аффективные психозы (маниакальные, депрессивные и циркулярные) в единый циркулярный психоз, который получил название «маниакально-депрессивное помешательство» (Каннабих Ю. В., 1928).
Однако уже современники Крепелина Кляйст и Вернике, а в России П. Б. Ганнушкин и С. А. Суханов (1902) рассматривали монополярную депрессию как особую форму заболевания с характерными патогенетическими особенностями. Последующее выделение К. Leongard униполярного и биполярного типов течения МДП (1957) явилось важным этапом в систематике аффективных расстройств. В дальнейшем такая дихотомия была закреплена в официальных диагностических руководствах: Американском Диагностическом и Статистическом Руководстве 4-го пересмотра (DSM-IV) и Международной Классификации Болезней 10-го пересмотра (МКБ-10), а семейные и генетические исследования показали относительную самостоятельность РДР и биполярного аффективного расстройства (БАР) (Angst J., 1966; Perris С., 1966). Так, по данным Нуллера Ю. А. и Михайленко И.Н. (1985) для аффективных расстройств характерна выраженная наследственная отягощенность, которая для биполярной депрессии выше (63,3 %) по сравнению с РДР (47,4 %). Также из РДР было выделено БАР II типа, который представляет собой сочетание депрессивных фаз и гипоманий (Dunner D. L. et al., 1976). По мнению Нуллера Ю.А. и Михайленко И.Н. (1985), разница в типах течения объясняется не генетической разнородностью маниакально-депрессивного психоза (МДП), а различной степенью «глубины» генетического процесса, что созвучно с учением Мореля о наследственно-дегенеративной природе психических заболеваний.
В настоящее время, несмотря на расширение границ БАР и появление понятия «биполярный спектр», БАР и РДР рассматриваются как два генетически самостоятельных заболевания. Исследование связи аффективных психозов с Х-хромосомой показало, что целесообразно разделение аффективных психозов по течению на биполярный и монополярный варианты (Вартанян М. Е., 1970). Оказалось, что биполярному психозу более свойственно наследование, сцепленное с Х-хромосомой. Большинство авторов признают, что аффективный психоз чаще встречается у женщин (60-70%). По данным Angst J. (1980), БАР чаще заболевают мужчины, а РДР в 3 раза чаще развивается у женщин. В 1994 году были изучены несколько поколений семей больных аффективными психозами (Berrettini W. Н. et al., 1997). Полученные данные показали, что локусы генов, возможно, имеющих отношение к развитию заболевания, расположены в перицентромерной области хромосомы 18 и на хромосоме 21 — область 21q22.3. В некоторых исследованиях обнаружена связь депрессивного синдрома с геном переносчика серотонина на хромосоме 17q и с геном рецептора D4, однако эти данные сложно считать достоверными (Артаментова Л. А. с соавт., 2004). Изучение распределения больных по возрасту начала заболевания показало, что в возрасте от 25 до 44 лет заболевают 46,5 %, т. е. около половины всех больных аффективными расстройствами (Киселев А. С. с соавт., 1988). С этим согласуются данные Беляева Б. С. (1989), показывающие, что биполярный тип МДП развивается в более молодом возрасте (до 25 лет) по сравнению с униполярной депрессией, которая обычно манифестирует после 30 лет. По данным Нуллера Ю. Л. и Михайленко И. Н. (1985), для РДР характерно более позднее начало (после 40 лет) (32,4%) по сравнению с БАР (18%). К настоящему времени показано, что различия между биполярной и монополярной депрессиями существуют не только на генетическом и клиническом уровнях изучения, но и в терапевтических подходах.
Длительные наблюдения показали, что многократные депрессивные эпизоды на протяжении жизни пациентов встречаются значительно чаще, чем одиночные (Hirschfeld R. М. А., 1994). Так, вероятность рецидива после впервые перенесенной депрессии составляет 60 %, а после второго и третьего эпизодов — 70 % и 90 %, соответственно (Sergeant J. К. et al., 1990). В более старых работах (табл. 1) число пациентов с частыми обострениями (более 3) колеблется от 13 до 54% (цит. по Каспер С., 1995).
По оценкам NIMH, у 50-85% всех пациентов, перенесших хотя бы 1 депрессивный эпизод, в течение жизни развивается повторный эпизод (Hirschfeld R. М. А., 1994). В результате 25-летнего исследования Angst J. с соавт. (1995) оказалось, что повторные эпизоды развиваются у 86,1 %, из них у 68,7% отмечаются 1-5 повторных эпизодов, а у 10,5 % более 10 повторных эпизодов. Исследования последних лет показали, что 60% больных, которые лечились в стационарах в связи с депрессивным состоянием, на протяжении последующих 16 лет наблюдения госпитализировались повторно, а рецидивы, не требовавшие госпитализации, возникали у 90% больных (Paykel Е., 2008). Известно также, что со временем депрессивные эпизоды имеют тенденцию к удлинению, а интермиссии укорачиваются (Каспер С., 1995).
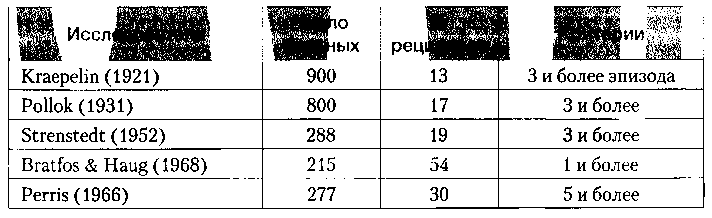
Таблица 1. Частота рецидивирования у пациентов, перенесших первый депрессивный эпизод (Каспер С., 1995)
Важной проблемой является склонность рекуррентной депрессии к затяжному течению и хронификации. Тенденция к учащению затяжных депрессивных приступов и хронификации депрессии наметилась после второй мировой войны (Hirschfeld R. М. А., 1994). Так, если в раннем исследовании Крепелина (1904) доля хронифицированной депрессии среди депрессивных состояний составляла 5%, то в большинстве послевоенных исследований она составляет 12-30% (Kinkelin М., 1954; Cassano G. В., 1979). По данным современной литературы, в течение первого года выздоравливает 48 % больных, у 33 % сохраняется депрессивная симптоматика, а спустя 5 лет у 12% происходит хронификации процесса, т.е. заболевание течет непрерывно (Hirschfeld R. М. А., 1994).
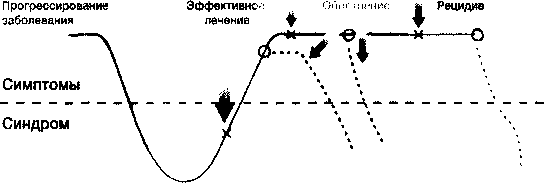
Важной для динамического понимания течения РДР и его терапии является модель заболевания, предложенная Kupfer в 1991 г. (рис. 1).
В соответствии с этой моделью процесс терапии РДР предполагает наличие трех этапов:
- Активная (купирующая) терапия длительностью 4-8 недель.
- Продолженная терапия (длительностью 4-6 месяцев на фоне устойчивой ремиссии) проводится антидепрессантами в терапевтической дозе. Продолженная терапия в настоящее время считается обязательным этапом даже при единичном депрессивном эпизоде (ДЭ) и следует за купирующей терапией. Ее целью является предотвращение рецидива перенесенного ДЭ. Риск обострений среди пациентов, не получающих поддерживающей фармакотерапии в первые полгода после прекращения симптомов депрессии, в среднем, равен 50 %. Адекватная по срокам и дозе фармакотерапия снижает угрозу рецидива депрессии до 10% (Thase М. Е., (1997). Максимальная эффективность терапии на данном этапе обнаружена при использовании эффективного в купирующий период антидепрессанта (АД) с сохранением прежней дозы (Frank Е. et al., 1990; Kupfer D. F. et al., 1992).
- Профилактическая терапия проводится сроком от одного года до неопределенно долгого периода (этот этап терапии подробно рассматривается ниже в соответствующем разделе).
Этапы терапии Активная Продолжение Поддерживающая Профилактическая терапии
Начиная с 60-х годов, для оценки тяжести депрессии наиболее часто используются следующие шкалы: шкала Гамильтона (HAMD) (Hamilton М.,1960), шкала Монтгомери — Асберг (MARDS) (Montgomery S., Asberg М., 1979), Нью-Кастлская шкала оценки эндогенной и реактивной депрессии (NEDRS) (Carney М., Garside R., 1965) и другие. Длительное время эффективность фармакотерапии депрессии оценивалась как положительная при уменьшении исходного количества баллов на 50 %. На профилактическом этапе главной задачей было сохранение достигнутого результата. В соответствии с современными подходами целью лечения депрессии на любом этапе считается достижение ремиссии (Аведисова А. С., 2004; Сарториус Н. с соавт., 2008 и др.). Хотя ремиссия и признается как оптимальный результат терапии депрессии, однако четкого общепринятого ее определения до настоящего времени не существует (Israel J., 2006).
Важнейшей характеристикой ремиссии является ее качество. Начиная с 90-х годов, этой проблеме посвящено много исследований. Во всех работах клиническая характеристика ремиссии, включающая оценку остаточной симптоматики, является одним из важных прогностических предикторов ее стойкости. Так, по данным L. Judd (1997), риск возникновения рецидива у пациентов с неполной ремиссией столь же высок, как у больных, перенесших 3 депрессивных эпизода. По результатам проспективного исследования с последующим 15-месячным наблюдением у пациентов с остаточными депрессивными симптомами в период ремиссии рецидивы развивались в 76% случаев, в то время как при отсутствии этих симптомов рецидивы наблюдались только у 25% больных (Ramana R. et al., 1995). Более поздние исследования, в том числе и с длительным многолетним наблюдением, показали, что у пациентов, не достигших полной ремиссии после проведенной терапии антидепрессантами, риск рецидивов выше, чем у больных с полной ремиссией (Judd L. et al., 1998,2000). Терапевтические стратегии достижения ремиссии предполагают, в частности, борьбу с резидуальными симптомами (Thase М., 2003), среди которых наиболее частыми являются симптомы тревоги, нарушения сна, депрессивное настроение, нарушение работоспособности, утомляемость и снижение интересов (Fava М., 2006; Nierenberg А., 1999). Показано, что значительное число пациентов не достигают ремиссии после 6-8-недельного курса терапии АД (Warden D. et al., 2007). Очевидно, что в практике период времени, за который устанавливается терапевтическая ремиссия, оказывается значительно большим, чем время достижения клинической эффективности препарата при проведении исследований (Mendlewicsz J., 2008).
Селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и ряд других современных АД являются приоритетными (первая линия терапии) на всех этапах терапии РДР, так как обладают лучшими профилями безопасности и переносимости, чем трициклические антидепрессанты (ТЦА) и обратимые ингибиторы моноаминоксидазы (ОИМАО).
В систематических обзорах (Gartlehner G. et al, 2007; Sartorius N. et al., 2007) не выявлено убедительных различий по эффективности и переносимости между АД нового поколения. Кроме того, не выявлено предикторов эффективности тех или иных АД, которые подтверждались бы в нескольких исследованиях, отвечающих критериям доказательности (Raymond W. et al., 2009).
В связи с убедительным преимуществом АД нового поколения ТЦА при терапии РДР в настоящее время рекомендованы только в качестве препаратов второго выбора в связи с худшей переносимостью и безопасностью (Lam R. et al., 2009). Тразодон также рассматривается как препарат второго выбора, поскольку обладает выраженным седативным действием. Последние рекомендации одного из таких руководств представлены в таблице 2.
Результаты сравнительных исследований эффективности СИОЗС и СИОЗСН неоднородны. Несколько РКИ показали преимущество СИОЗН (Nemeroff С. et al., 2008; Kennedy S. et al., 2009), однако другие исследования не подтверждают эти выводы (National Institute for Clinical Excellence, 2004; Gartlehner et al., 2007). В ряде мета-анализов показано преимущество кломипрамина, эсциталопрама и венлафаксина (как минимум, два РКИ и/или поддержка в мета-анализах) и вероятное преимущество дулоксетина, миансерина и миртазапина по сравнению с СИОЗС, однако эти результаты получены в основном при сравнении с флуоксетином (Montgomery S. et al., 2007). Недавний мета-анализ, в котором сравнивались двенадцать АД нового поколения, выявил незначительное преимущество эсциталопрама, миртазапина, сертралина и венлафаксина перед другими препаратами (Cipriani A. et al., 2009). В то же время имеются данные, что при тяжелых депрессиях, особенно при госпитальных вариантах, электросудорожная терапия, ТЦА и препараты двойного действия имеют преимущества перед СИОЗС и ОИМАО (Anderson I., 1998, 2000; Cipriani A. et al., 2006 и др.).
Эффективность атипичного антипсихотика кветиапина при купирующей терапии рекуррентной депрессии была изучена в мультицентровом РКИ на 612 пациентах, которым назначались кветиапин (300 мг/сут), кветиапин XR (150 мг/сут), дулоксетин (60 мг/сут) и плацебо (Montgomery S. et al., 2008). В группах кветиапина, кветиапина XR и дулоксетина были получены сопоставимые результаты, все три препарата достоверно превосходили плацебо. Однако, учитывая профиль переносимости кветиапина и небольшое количество данных по сравнению этого препарата с СИОЗС и другими АД, кветиапин пока рекомендуют только в качестве второй линии терапии. Учитывая поливалентный механизм действия кветиапина, этот препарат может оказаться эффективен у некоторых особых групп депрессивных больных.
Актуальной и широко дискутируемой в настоящее время проблемой, имеющей большое значение в клинической практике, является определение сроков наступления терапевтического эффекта. До последнего времени было принято считать, что ожидание терапевтического эффекта может занимать до 3-4 недель от начала лечения. Однако недавние исследования показали, что более раннее начало действия является критерием более вероятного ответа на терапию. С одной стороны, есть данные нескольких мета-анализов о том, что антидепрессивное действие может проявиться только на 1-2-й неделе после начала приема препарата (Papakostas G. et al., 2006; Taylor M. et al., 2006), в последующие недели уровень ответа на лечение снижается (Taylor М. et al., 2006). С другой стороны, раннее улучшение может быть показателем достижения ремиссии (Wade A., Friis А.Н.,2006).
Важным фактором, влияющим на эффективность антидепрессивной терапии, является переносимость. В настоящее время имеются результаты значительного числа исследований, показывающих преимущества АД нового поколения над ТЦА (Lam R. et al., 2007). Сообщалось о нескольких редких, но серьезных побочных эффектах при длительном использовании АД нового поколения.
Серотониновый синдром является редким осложнением и чаще всего развивается при одновременном приеме СИОЗС/СИОЗСН с ИМАО или другими серотонинергическими препаратами. Недавние мета-анализы указывают, что применение СИОЗС несколько повышает риск кровотечений в верхнем отделе желудочно-кишечного тракта (ЖКТ), особенно в комбинации с нестероидными противовоспалительными средствами (Loke Y. et al., 2008). В отличие от ТЦА, риск судорожных припадков при приеме СИОЗС и более новых групп АД не отличается от показателей общей популяции (приблизительно 0,04 %). В случае передозировки обнаружена достоверно большая кардиотоксичность венлафаксина, чем других СИОЗС (Deshauer D., 2007). Мета-анализы продемонстрировали, что переносимость флувоксамина несколько хуже по сравнению с другими СИОЗС (Anderson I., 2000), тогда как эсциталопрам и сертралин пациенты прекращают принимать реже других АД (Cipriani A. et al., 2009).
Несмотря на значительный прогресс тимоаналептической терапии, по-прежнему не существует препаратов, удовлетворяющих строгим требованиям к антидепрессанту: быстрое начало действия, высокая эффективность, оптимальная способность предотвращать рецидивы и суицидальные тенденции. Кроме того, при лечении любым АД у 20-50% больных эффект не достигается (Laux, 1994), а 30 % депрессий остаются резистентными к любой фармакотерапии. Поэтому исследования в области купирующей терапии депрессии в рамках РДР по-прежнему остаются актуальной задачей.
Хронический рецидивирующий характер течения РДР определяет необходимость проведения вторичной профилактики рецидивов заболевания. В настоящее время под профилактическим эффектом подразумевается способность ряда препаратов при длительном непрерывном приеме подавлять развитие рецидива или уменьшать выраженность очередной аффективной фазы (Мосолов С. Н., 1995). Психофармакотерапия была и остается в настоящее время единственным эффективным методом предотвращения рецидивов РДР (Hirschfeld R., 2001). Вторичная профилактика циркулярных аффективных расстройств — одно из самых молодых направлений в терапии психических заболеваний. Оно подвергается динамичному развитию с быстрым расширением арсенала используемых лекарственных средств, накоплением клинического опыта их применения, отработкой оптимальных стратегий длительной терапии.
Способность предотвращать развитие повторных аффективных фаз впервые была обнаружена в середине 60-х годов у солей лития (СЛ). Для определения свойств этого препарата был предложен термин «пормотимик», обозначающий способность СЛ подавлять появление как депрессивных, так и маниакальных симптомов.
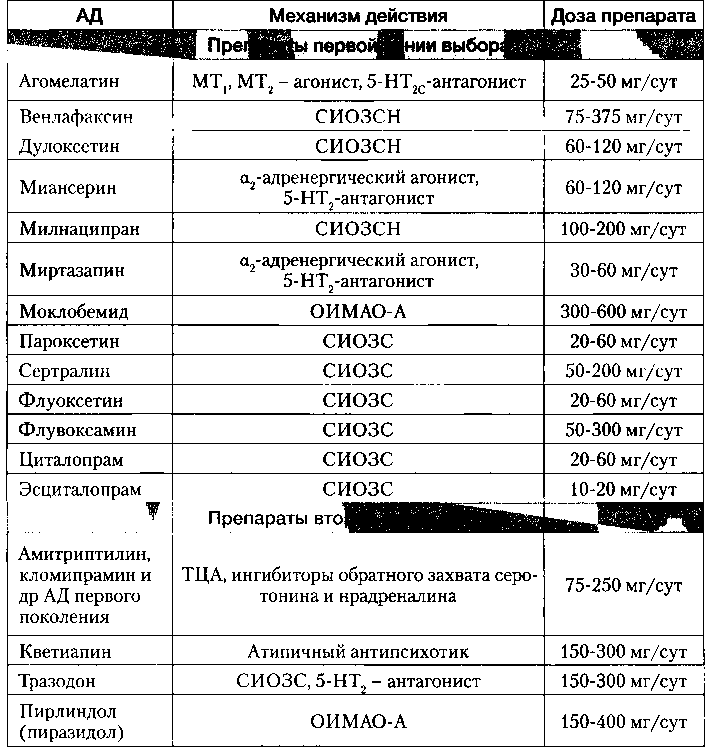
Таблица 2. Препараты, рекомендованные для фармакотерапии РДР (адаптировано из Lam R. et al. Canadian Network for Mood and Anxiety Treatments -CANMAT, 2009)
К настоящему моменту группа препаратов с нормотимическим действием включает в себя карбамазепин (КБЗ), соли вальпроевой кислоты (прежде всего вальпроат натрия) и ламотриджин.
Эффективность противорецидивного действия СЛ при РДР доказана в нескольких рандомизированных клинических исследованиях (Prien R. et al., 1973; Fieve R. et al., 1976). Два проведенных мета-анализа показали преимущество СЛ над плацебо при терапии РДР (Souza F. et al., 1991; Burgess S. et al., 2001). Однако только в одном мета-анализе их преимущество было достоверным (Souza F. et al., 1991). Кроме того, их длительнее применение при терапии РДР вызывало довольно большое число побочных явлений. Эти обстоятельства привели к необходимости поиска препаратов со сходным «нормотимическим» действием, но не вызывающих столь значительного числа побочных эффектов. Такие свойства были обнаружены у ряда «малых» антиконвульсантов (КБЗ, соли вальпроевой кислоты, ламотриджин). Обоснованность применения КБЗ при профилактической терапии РДР существенно меньше, чем при профилактике БАР. Препарат изучался лишь в двух небольших слепых сравнительных исследованиях с СЛ (Placidi G. et al., 1986; Simhandl C. et al., 1993). В обеих работах показана равная эффективность КБЗ и СЛ. В рекомендациях Всемирной федерации обществ биологической психиатрии (WFSBP) предложено использование КБЗ при непереносимости АД и СЛ (Bauer М. et al., 2002). Также КБЗ может быть использован для интенсификации профилактической терапии при неэффективности монотерапии АД (Bauer М. et al., 2002). Исследования профилактической эффективности КБЗ демонстрируют спорные результаты. Так, в исследовании Тювиной Н. А. с соавт. (2005) при поддерживающей терапии КБЗ наблюдалось достоверное уменьшение продолжительности эпизодов, однако отмечалось достоверное снижение длительности третьей интермиссии (р<0,05). Эффективность КБЗ при длительной терапии РДР изучалась в ряде отечественных работ (Вовин Р.Я., 1987, 1994; Костюкова Е. Г., 1989). Однако большая часть этих данных получена в исследованиях, включавших больных как с монополярным, так и с биполярным типом течения маниакально-депрессивного психоза, поэтому группы пациентов с униполярной депрессией в этих исследованиях были невелики.
Более изученными и признанными для профилактики РДР препаратами являются АД. Уже первые исследования противорецидивной эффективности ТЦА при РДР показали хороший результат. В каждой методологически корректной научной работе АД оказались эффективнее плацебо. В большинстве первых работ исследовались следующие ТЦА: амитриптилин, имипрамин, нортриптилин (Prien R. et al., 1973; Coppen A. et al., 1978; Frank E. et al., 1990; Kupfer D. et al., 1992). Одним из наиболее изученных ТЦА является имипрамин. Классическое исследование, посвященное профилактической эффективности АД, проведено Frank Е., Kupfer D. (1990). Исследование, длившееся 5 лет, показало высокую профилактическую эффективность имипрамина в дозах 150-200 мг/сут. Имипрамин существенно превосходил по эффективности плацебо (р<0,01).
Эффективность амитриптилина показана в двух РКИ (Coopen А. et al., 1978; Glen A. et al., 1984). Способность достоверно уменьшать риск рецидива депрессии выявлена также у препаратов тетрациклической структуры (с различным механизмом действия) — мапротилина (Rouillon F. с соавт., 1991) и миансерина (Kishimoto А. с соавт., 1994).
Оказавшись эффективным профилактическим средством, ТЦА в связи с наличием побочных эффектов не всегда могли применяться столь длительно и в той дозе, как того требовала клиническая картина заболевания (Montgomery S. A. et al., 1989). Как известно, одним из наиболее частых побочных эффектов ТЦА является седация, сопровождающаяся вялостью, повышенной сонливостью, снижением концентрации внимания и работоспособности. Причем наибольшими седативными свойствами обладают амитриптилин и миансерин.
Эти и ряд других нежелательных явлений серьезно затрудняют длительную терапию ТЦА и тетрациклическими антидепрессантами в адекватных дозах. Даже незначительные нежелательные явления (НЯ), возникшие во время профилактической терапии, могут приводить к преждевременному прекращению лечения.
Появление АД нового поколения с лучшим профилем переносимости привело к быстрому развитию направления профилактической тимоаналептической терапии и ее широкому внедрению в практическую психиатрию. Из антидепрессантов нового поколения для профилактики РДР широко применяются СИОЗС. Противорецидивный эффект пароксетина при рекуррентной депрессии был показан в двойном-слепом плацебо-контролируемом исследовании (Montgomery S., Dunbar G., 1993) и двух слепых сравнительных исследованиях с имипрамином (Claghorn J. et al., 1993; 0hrberg S. et al., 1992). Так, в исследовании Montgomery S., Dunbar G. (1993), длительность которого составляла 1 год, пароксетин оказался эффективнее плацебо. В двойном слепом, плацебо-контролируемом исследовании, выполненном на 219 пациентах, терапия пароксетином (средняя доза 38 мг/сут) или имипрамином (средняя доза 189 мг/сут) продолжалась на протяжении 1 года после достижения эффекта купирующей терапии (Claghorn J. et al., 1993). Оба препарата оказались эффективнее плацебо, однако частота НЯ в группе имипрамина была достоверно выше. В слепом сравнительном исследовании Franchini L. et al., (1998) показано, что профилактический эффект пароксетина является дозозависимым. Больные с положительным эффектом купирующей терапии пароксетином были рандомизированы в две группы для последующей профилактической терапии. На протяжении 28 месяцев пациенты одной группы получали пароксетин в дозе .20 мг/сут, другой — 40 мг/сут. Результаты исследования показали более выраженную противорецидивную эффективность дозы 40 мг по сравнению с дозой 20 мг (р<0,05). Профилактические свойства доказаны и у другого СИОЗС — флуоксетина (Montgomery S. et al., 1988; Gilaberte I. et al., 2001). В исследовании Frederick W. et al.
(1998) (62 недели) флуоксетин оказался значительно эффективнее плацебо (15,4% рецидивов в группе флуоксетином и 29% в группе плацебо), при этом большая часть рецидивов в группе плацебо пришлась на первые полгода терапии. При длительной терапии снижают риск рецидива РДР и другие СИОЗС: циталопрам (Montgomery S. et al., 1993; Hochstrasser В. et al., 2001), флувоксамин (Terra J. et al., 1998) и сертралин (Doogan D. et al., 1992; Montgomery S. et al., 1991).
Профилактические свойства показаны у ОИМАО. Так, доказана эффективность моклобемида при профилактике рецидивов РДР (Moll Е. et al., 1994). Доказана также профилактическая эффективность норадренергического и специфического серотонинергического антидепрессанта миртазапина (Montgomery S. et al., 1998). В длительном (2 года) плацебо-контролируемом сравнительном исследовании миртазапина с амитриптилином на этапе продолженной терапии (20 недель) он оказался эффективнее плацебо (р<0,001) и амитриптилина (р<0,05). На этапе профилактической терапии препарат превосходил плацебо (р<0,001) и был несколько эффективнее амитриптилина (р=0,075). Выраженное преимущество миртазапина, возможно, было связано с невысокой дозой амитриптилина (в среднем, 127 мг/сут) вследствие плохой переносимости более высоких доз амитриптилина при длительном приеме.
Свою профилактическую эффективность в двухлетнем открытом мультицентровом исследовании доказал и дулоксетин (Raskin J. et al., 2002). Доля респондеров к окончанию исследования составила 89,1 %, а пациентов, достигших ремиссии — 81,8%. Также эффективным при профилактике рецидивов РДР оказался бупропион, что показало двойное слепое исследование (Weihs К. et al., 2002), в котором после 2 лет терапии по показателю Каплана-Мейера до конца исследования дошло 52 % пациентов в группе больных, принимавших бупропион, и всего 37 % в группе плацебо (р=0,003).
Эффективен при профилактике рецидивов РДР агонист мелатонинергических MT1- и МТ2-рецепторов и антагонист серотонинергических 5-НТ2С-рецепторов агомелатин (Goodwin G. et al., 2009).
Появление большого числа новых препаратов и проведение значительного количества доказательных исследований привело к качественному прорыву в понимании терапии РДР на границе 80-х и 90-х годов. Группой специалистов в области профилактической терапии аффективных расстройств (Montgomery S. et al., 1988, 1993; Kupfer D.J., 1989, 1991; Kasper S., 1991) была научно обоснована необходимость проведения профилактической терапии при РДР, а также сформулированы основные принципы ее проведения и методологические требования к научным исследованиям в этой области. Целесообразность профилактической терапии при РДР на современном этапе обосновывается следующими фактами:
- около 50-80 % пациентов с депрессией отмечают в течение жизни повторное обострение;
- риск обострений нарастает с возрастом и пропорционален числу перенесенных эпизодов;
- с увеличением числа эпизодов длительность ремиссий сокращается;
- имеются данные об эффективности АД при профилактике ДЭ;
- терапевтический ответ на АД-терапию может ослабевать с увеличением числа перенесенных эпизодов;
- с каждым эпизодом нарастает инвалидизация и снижается качество жизни пациентов.
Множество открытых вопросов до настоящего времени связано с длительностью профилактической терапии. ВОЗ (1989) рекомендует назначать профилактическую терапию больным, у которых было два тяжелых депрессивных эпизода в течение последних 5 лет и продолжать ее не менее 2 лет после исчезновения всех симптомов РДР.
Современный этап изучения длительной терапии РДР предъявляет высокие требования к терминологии, используемой при ее описании и анализе результатов. Работа по созданию единого терминологического языка в области профилактики РДР завершилась к началу 90-х годов (FranK Е., 1991; Kupfer D.J., 1991; Montgomery S. et al., 1988,1993).
- Неполная ремиссия — период, во время которого отмечается значительное улучшение, но сохраняются симптомы, не достигающие синдромального единства.
- Полная ремиссия — отсутствие каких-либо признаков аффективного расстройства на протяжении 6 месяцев.
- Выздоровление — ремиссия длительностью более 6 месяцев, но также ограниченная во времени.
- Обострение — возобновление симптоматики до уровня значительной степени выраженности в период ремиссии (до выздоровления).
- Повторный эпизод — развитие нового депрессивного эпизода после выздоровлении от предыдущего.
- При профилактической терапии РДР применяются различные стратегии. Наиболее подробно эти подходы описаны Altamura А. С. et al. (1993):
- Продолжение фармакотерапии АД (нормотимиком) в полной терапевтической дозе.
- Продолжение фармакотерапии АД (нормотимиком) в редуцированной дозе.
- Прекращение фармакотерапии АД (нормотимиком) по завершении долечивающей терапии (4-6 месяцев) с ранним началом лечения при первых признаках новой фазы.
Активная терапевтическая стратегия (1-й вариант) рекомендована при частом рецидивировании, значительной тяжести ДЭ и относительном соматоневрологическом благополучии пациентов. Длительный прием АД предъявляет очень высокие требования к переносимости. Большинство современных исследований показало, что сравнительная профилактическая эффективность ТЦА и новых АД в адекватных дозах была примерно равной, статистически значимого преимущества новых препаратов выявлено не было. Однако практически в каждом сравнительном исследовании профилактической терапии отмечалось статистически значимое преимущество новых АД над ТЦА по переносимости, комплаенсу и статистической «выживаемости» пациентов к концу исследования, т.е. более редком выбывании больных из исследования, что, в значительной мере, связано с более высокой переносимостью препаратов нового поколения.
Второй вариант длительной терапии рекомендуется при более благоприятной форме течения РДР. Очевидно, что в ряде случаев эффективная терапевтическая доза оказывается достаточно высокой, что сопровождается побочными эффектами. Известно, что большинство ТЦА при длительном применении обладают кардиотоксическим действием, многие АД гепатотоксичны, так что вопрос о целесообразности длительной терапии в больших дозах у некоторых категорий пациентов (пожилых, соматически неблагополучных) иногда решается в пользу уменьшения дозы АД. Эта схема терапии может использоваться у пациентов с нетяжелыми формами депрессии (легкий ДЭ) или нечастыми депрессиями (2 и менее депрессивных эпизода за 5 лет).
Дифференцированные показания для назначения большинства АД с профилактической целью разработаны недостаточно. Для значительного количества АД, появившихся в последние годы, эти рекомендации фрагментарны и нуждаются в проведении дополнительных исследований и мета-анализов.
До настоящего времени не очевидна стратегия терапии во время обострения депрессивной симптоматики на фоне уже имеющейся профилактической терапии АД (повышение дозы, смена, добавление другого препарата). Имеющиеся рекомендации общего характера, в первую очередь предложения Altamura С. A., Percudani М. (1993), нуждаются в корректировке в связи с появлением новых препаратов.
Одним из наиболее важных в области долгосрочной терапии РДР является вопрос показаний для прекращения профилактической терапии. Исходя из данных некоторых длительных (3-5 лет) исследований пациентов с диагнозом РДР (Frank Е. et al.,1990, Kupfer D.J. et al., 1992), отменять поддерживающую терапию вообще не следует. В приведенном исследовании после 3 лет профилактической терапии пациенты, принимавшие имипрамин, были снова рандомизированы и разделены на 2 группы (имипрамин и плацебо). Следующие 2 года терапии показали, что имипрамин оказался значительно эффективнее плацебо (р<0,05). По имеющимся рекомендациям при плановом окончании профилактической терапии или вынужденном преждевременном прекращении (из-за плохой комплаентности или соматических причин) рекомендуется отмена препарата путем поэтапного снижения дозы. Период снижения дозы должен занимать не менее 4-6 месяцев (Bauer М. et al., 2002).
Несмотря на значительный прогресс тимоаналептической терапии РДР, сохраняется ряд серьезных препятствий для успешной фармакотерапии на всем протяжении заболевания. По-прежнему, не решена проблема резистентности к терапии АД, следствием которой является увеличение числа пациентов с хронифицированным течением заболевания. Нерешенной проблемой является и отставленный эффект большинства АД (4-6 недель). По-прежнему не разработан и дифференцированный подход к выбору АД при проведении терапии. Последнее особенно важно в связи с большим количеством новых АД и отсутствием рекомендаций по терапии, которые основывались бы одновременно на результатах проведенных исследований и клинических наблюдениях. Для решения всех этих проблем необходимо не только продолжение фундаментальных исследований патогенеза депрессии и создание новых, более совершенных препаратов, удовлетворяющих всем клиническим требованиям терапии РДР, но и проведение исследований, направленных на разработку дифференцированных подходов к применению уже имеющихся антидепрессантов и четких алгоритмов терапии этого заболевания.