Воспаление — сложная местная реакция организма на повреждение, направленная на уничтожение повреждающего фактора и восстановление поврежденных тканей, которая проявляется характерными изменениями в микроциркуляторном русле и соединительной ткани.
Признаки воспаления были известны еще древним врачам, которые считали, что его характеризуют 5 симптомов: краснота (rubor), опухоль тканей (tumor), жар (calor), боль (dolor) и нарушение функций (functio laesa). Для обозначения воспаления к названию органа, в котором оно развивается, прибавляют окончание «ит»: кардит — воспаление сердца, нефрит — воспаление почки, гепатит — воспаление печени и т. д.
Биологический смысл воспаления заключается в отграничении и ликвидации очага повреждения и вызвавших его патогенных факторов, а также в восстановлении гомеостаза.
Воспаление характеризуется следующими особенностями.
Воспаление — это защитно-приспособительная реакция, возникшая в ходе эволюции. Благодаря воспалению происходит стимуляция многих систем организма, он избавляется от инфекционного или другого повреждающего фактора; обычно в исходе воспаления возникает иммунитет и устанавливаются новые взаимоотношения с окружающей средой.
В результате не только oтдельные люди, но и человечество, как биологический вид, приспосабливается к изменениям того мира, в котором оно живет, — атмосферы, экологии, микромира и т. д. Однако у конкретного человека воспаление иногда может привести к тяжелым осложнениям, вплоть до смерти больного, так как на течение воспалительного процесса влияют особенности реактивности организма этого человека — его возраст, состояние защитных систем и т. п. Поэтому воспаление нередко требует медицинского вмешательства.
Воспаление — типовой общепатологический процесс, которым организм отвечает на самые различные воздействия, поэтому оно имеет место при большинстве заболеваний и сочетается с другими реакциями.
Воспаление может быть самостоятельным заболеванием в тех случаях, когда оно составляет основу болезни (например, крупозной пневмонии, остеомиелита, гнойного лептоменингита и др.). В этих случаях воспаление имеет все признаки заболевания, т. е. специфическую причину, своеобразный механизм течения, осложнения и исходы, что требует целенаправленного лечения.
Воспаление и иммунитет.
Между воспалением и иммунитетом существует как прямая, так и обратная связь, так как оба процесса направлены на «очищение» внутренней среды организма от чужеродного фактора или измененного «своего» с последующим oтторжением чужеродного фактора и ликвидацией последствий повреждения. В процессе воспаления формируются иммунные реакции, а сам иммунный ответ реализуется через воспаление и от выраженности иммунного ответа организма зависит течение воспаления. Если иммунные средства защиты эффективны, воспаление может вообще не развиться. При возникновении иммунных реакций гиперчувствительности (см. главу 8) воспаление становится их морфологическим проявлением — развивается иммунное воспаление (см. ниже).
Для развития воспаления, помимо повреждающего фактора, необходимо сочетание различных биологически активных веществ, определенных клеток, межклеточных и клеточно-матриксных отношений, развитие местных изменений тканей и общих изменений организма.
Воспаление — это сложный комплекс процессов, который складывается из трех взаимосвязанных реакций — альтерации (повреждения), экссудации и полиферации.
Отсутствие хотя бы одной из этих трех составляющих реакций не позволяет говорить о воспалении.
Альтерация — повреждение тканей, при котором возникают разнообразные изменения клеточных и внеклеточных компонентов в месте действия повреждающего фактора.
Экссудация — поступление в очаг воспаления экссудата, т. е. богатой белком жидкости, содержащей форменные элементы крови, в зависимости от количества которых образуются различные экссудаты.
Пролиферация — размножение клеток и формирование внеклеточного матрикса, направленных на восстановление поврежденных тканей.
Необходимым условием развития этих реакций является наличие медиаторов воспаления.
Медиаторы воспаления — биологически активные вещества, обеспечивающие химические и молекулярные связи между процессами, протекающими в очаге воспаления и без которых развитие воспалительного процесса невозможно.
Выделяют 2 группы медиаторов воспаления:
Клеточные (или тканевые) медиаторы воспаления, с помощью которых включается сосудистая реакция и обеспечивается экссудация. Эти медиаторы продуцируются клетками и тканями, ocoбенно лаброцитами (тучными клетками), базофильными и эозинофильными гранулоцитами, моноцитами, макрофагами, лимфоцитами, клетками APUD-системы и др. Важнейшими клеточными медиаторами воспаления являются:
• биогенные амины, особенно гистамин и серотонин, вызывающие острую дилатацию (расширение) сосудов микроциркуляторного русла, что повышает сосудистую проницаемость, способствует отеку ткани, усиливает слизеобразование и сокращение гладкой мускулатуры:
- кислые липиды, образующиеся при повреждении клеток и тканей и сами являющиеся источником тканевых медиаторов воспаления;
- медленно регулирующая субстанция анафилаксии увеличивает сосудистую проницаемость;
- эозинофильный хемотаксический фактор А повышает cocyдистую проницаемость и выход в очаг воспаления эозинофилов;
- фактор активации тромбоцитов стимулирует тромбоциты и их многогранные функции;
- простагланданы обладают широким спектром действия, в том числе повреждают сосуды микроциркуляции, повышают их проницаемость, усиливают хемотаксис, способствуют пролиферации фибробластов.
Плазменные медиаторы воспаления образуются в результате активации под влиянием повреждающего фактора и клеточных медиаторов воспаления трех плазменных систем — системы комплемента, системы плазмина (каллекриин-кининовой системы) и свертывающей системы крови. Все компоненты этих систем находятся в крови в виде предшественников и начинают функционировать только под влиянием определенных активаторов.
- Медиаторами кининовой системы являются брадикинин и калликреин. Брадикинин усиливает сосудистую проницаемость, вызывает чувство боли, обладает гипотензивным свойством. Калликреин осуществляет хемотаксис лейкоцитов и активирует фактор Хагемана, включая, таким образом, в воспалительный процесс системы свертывания крови и фибринолиза.
- Фактор Хагемана, ключевой компонент системы свертывания крови, инициирует свертываемость крови, активирует другие плазменные медиаторы воспаления, повышает npoницаемость сосудов, усиливает миграцию нейтрофильных лейкоцитов и агрегацию тромбоцитов.
- Система комплемента состоит из группы специальных белков плазмы крови, вызывающих лизис бактерий и клеток, компоненты комплемента СЗb и С5b повышают проницаемость сосудов, усиливают движение к очагу воспаления полиморфно-ядерных лейкоцитов (ПЯЛ), моноцитов и макрофагов.
Реактанты острой фазы — биологически активные белковые вещества, благодаря которым в воспаление включаются не только система микроциркуляции и иммунная система, но и другие системы организма, в том числе эндокринная и нервная.
Среди реактантов острой фазы наибольшее значение имеют:
- С-реактивный белок, концентрация которого в крови увеличивается при воспалении в 100—1000 раз, активирует цитолитическую активность Т-лимфоцитов-киллеров. замедляет агрегацию тромбоцитов;
- интерлейкин-1 (ИЛ-1), влияет на активность многих клеток очага воспаления, особенно Т-лимфоцитов, ПЯЛ, стимулирует синтез простагландинов и простациклинов в эндотелиальных клетках, способствует гемостазу в очаге воспаления;
- Т-кининоген является предшественником плазменных медиаторов воспаления — кининов, ингибирует (цистеиновые протеиназы.
Таким образом, в очаге воспаления возникает гамма очень сложных процессов, которые не могут долго протекать автономно, не являясь сигналом для включения различных систем opганизма. Такими сигналами являются накопление и циркуляция в крови биологически активных веществ, кининов. компонентов комплемента, простагландинов, интерферона и др. В результате этого в воспаление вовлекаются система кроветворения, иммунная, эндокринная, нервная системы, т. е. организм в целом. Поэтому в широком плане воспаление следует рассматривать как местное проявление общей реакции организма.
Воспаление обычно сопровождает интоксикация. Она связана не только с самим воспалением, но и с особенностями повреждающего фактора, прежде всего инфекционного агента. По мере увеличения площади повреждения и выраженности альтерации усиливается всасывание токсичных продуктов и нарастает интоксикация, которая угнетает различные защитные системы организма — иммунокомпетентную, кроветворную, макрофагальную и др. Интоксикация часто оказывает определяющее влияние на течение и характер воспаления. С этим в первую очередь связана недостаточная эффективность воспаления, например, при остром разлитом перитоните, ожоговой болезни, травматической болезни и многих хронических инфекционных заболеваниях.
ПАТОФИЗИОЛОГИЯ И МОРФОЛОГИЯ ВОСПАЛЕНИЯ
В своем развитии воспаление проходит 3 стадии, последовательность которых и определяет течение всего процесса.
СТАДИЯ АЛЬТЕРАЦИИ
Стадия альтерации (повреждения) — начальная, пусковая стадия воспаления, характеризующаяся повреждением тканей. В этой стадии развивается хелюаттракция, т.е. привлечение к очагу повреждения клеток, продуцирующих медиаторы воспаления, необходимые для включения в процесс сосудистой реакции.
Хемоаттрактанты — вещества, определяющие направление движения клеток в тканях. Они продуцируются микробами, клетками, тканями, содержатся в крови.
Непосредственно после повреждения из тканей выделяются такие хемоаттрактанты, как просеринэстераза, тромбин, кинин, а при повреждении сосудов — фибриноген, активированные компоненты комплемента.
В результате совокупной хемоаттракции в зоне повреждения возникает первичная кооперация клеток, продуцирующих медиаторы воспаления, — скопление лаброцитов, базофильных и эозинофильных гранулоцитов, моноцитов, клеток APUD-системы и др. Только находясь в очаге повреждения, эти клетки обеспечивают выброс тканевых медиаторов и начало воспаления.
В результате действия тканевых медиаторов воспаления в зоне повреждения происходят следующие процессы:
- повышается проницаемость сосудов микроциркуляторного русла;
- в соединительной ткани развиваются биохимические изменения приводящие к задержке в тканях воды и к набуханию внеклеточного матрикса;
- инициальная активация плазменных медиаторов воспаления под влиянием повреждающего фактора и тканевых медиаторов;
- развитие дистрофических и некротических изменений тканей в зоне повреждения;
- высвобождающиеся из клеточных лизосом и активирующиеся в очаге воспаления гидролазы (протеазы, липазы, фосфолипазы, эластазы, коллагеназы) и другие ферменты играют существенную роль в развитии повреждений клеток и неклеточных структур:
- нарушения функций, как специфических — того органа, в котором возникла альтерация, так и неспецифических — терморегуляции, местного иммунитета и др.
СТАДИЯ ЭКССУДАЦИИ
Б. Стадия экссудации наступает в разные сроки вслед за повреждением тканей в ответ на действие клеточных и особенно плазменных медиаторов воспаления, образующихся при активации кининовой, комплементарной и свертывающей систем крови. В динамике стадии экссудации различают 2 этапа: плазматическая экссудация и клеточная инфильтрация.
Плазматическая экссудация обусловлена первоначальным расширением сосудов микроциркуляторного русла, усилением притока крови к очагу воспаления (активная), что приводит к повышению гидростатического давления в сосудах. Активная способствует развитию оксигенации очага воспаления, в результате чего возникают следующие процессы:
- образование активных форм кислорода;
- приток гуморальных факторов защиты — комплемента, фибронектина, пропер дина и др.;
- приток ПЯЛ, моноцитов, тромбоцитов и других клеток крови.
Клеточная инфильтрация — поступление в зону воспаления различных клеток, прежде всего клеток крови, что связано с замедлением кровотока в венулах (пассивная ) и действием медиаторов воспаления.
При этом развиваются следующие процессы:
- лейкоциты перемещаются на периферию осевого потока крови;
- катионы плазмы крови Са2+, Мn и Mg2+ снимают отрицательный заряд клеток эндотелия и лейкоцитов и лейкоциты прилипают к стенке сосуда (адгезия лейкоцитов);
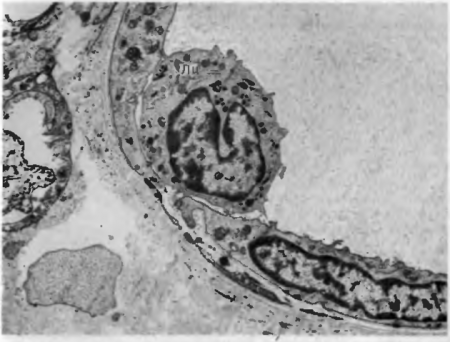
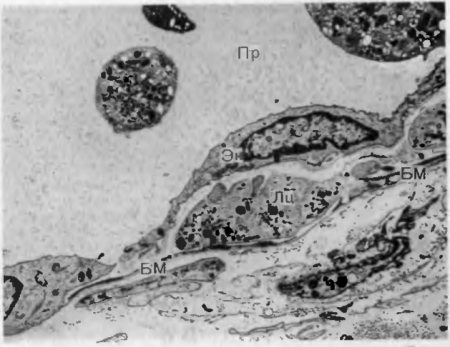
- возникает краевое состояние лейкоцитов,т. е. остановка их у стенки сосудов (рис. 22);
Сегментоядерный лейкоцит (Лц) располагается под эндотелиальной клеткой (Эн) около базальной мембраны (БМ) сосуда.
- препятствует оттоку экссудата, токсинов, возбудителей из очага воспаления и быстрому нарастанию интоксикации и распространению инфекции.
Тромбоз сосудов зоны воспаления развивается после эмиграции клеток крови в очаг воспаления.
Взаимодействие клеток в очаге воспаления.
- Полиморфноядерные лейкоциты обычно первыми поступают в очаг воспаления. Их функции:
- отграничение очага воспаления;
- локализация и уничтожение патогенного фактора,
- создание кислой среды в очаге воспаления с помощью выброса (экзоцитоза) гранул, содержащих гидролазы
- Макрофаги, особенно резидентные, появляются в очаге повреждения еще до развития воспаления. Их функции весьма многообразны. что делает макрофаг и одной из главных клеток воспалительной реакции:
- они осуществляют фагоцитоз повреждающего агента;
- выявляют антигенную природу патогенного фактора;
- индуцируют иммунные реакции и участие иммунной системы в воспалении;
- обеспечивают нейрализацию токсинов в очаге воспаления;
- обеспечивают многообразные межклеточные взаимодействия, прежде всего с ПЯЛ, лимфоцитами, моноцитами, фибробластами;
- взаимодействуя с ПЯЛ, обеспечивают фагоцитоз повреждающего агента;
- взаимодействие макрофагов и лимфоцитов способствует развитию реакции гиперчувствительности замедленного типа (ГЗТ) в виде иммунного цитолизе и гранулематоза;
- взаимодействие макрофагов и фибробластов направлено на стимуляцию образования коллагена и различных фибрилл.
- Моноциты являются предшественниками макрофагов, циркулируют в крови, выходят в очаг воспаления, трансформируясь в макрофаги.
- Клетки иммунной системы — Т- и В-лимфоциты, плазматические клетки:
- различные субпопуляции Т-лимфоцитов определяют активность иммунной реакции;
- Т-лимфоциты-киллеры обеспечивают гибель биологических патогенных факторов, обладают цитолитическим свойством по отношению к собственным клеткам организма;
- В-лимфоциты и плазмоциты участвуют в выработке специфических антител (см. главу 8), обеспечивающих ликвидацию повреждающего фактора.
- Фибробласты являются основными продуцентами коллагена и эластина, составляющих основу соединительной ткани. Появляются уже на начальных этапах воспаления под влиянием цитокинов макрофагов, в значительной степени обеспечивают восстановление поврежденных тканей.
- Другие клетки (эозинофилы, эритроциты), появление которых зависит от причины воспаления.
Все эти клетки, а также внеклеточный матрикс, компоненты соединительной ткани взаимодействуют между собой благодаря многочисленным активным веществам, определяющим клеточную и внеклеточную рецепцию — цитокинам и факторам роста. Реагируя с рецепторами клеток и внеклеточного матрикса, они активируют или ингибируют функции клеток, участвующих в воспалении.
Лимфомикрососудистая система участвует в воспалении синхронно с гемомикроциркуляторным руслом. При выраженной инфильтрации клеток и пропотевании плазмы крови в области венулярного звена микроциркуляторного русла вскоре в процесс вовлекаются корни «ультрациркуляторной» системы интерстициальной ткани — интерстициальные каналы.
В результате в зоне воспаления происходит:
- нарушение кроветканевого баланса;
- изменение внесосудистой циркуляции тканевой жидкости;
- возникновение отека и набухания ткани;
- развивается лимфостаз. в результате чего лимфатические капилляры переполняются лимфой. Она выходит в окружающие ткани и возникает острый лимфатический отек.
Некроз тканей является важным компонентом воспаления, так как несет несколько функций:
- в очаге некроза вместе с гибнущими тканями должен погибнуть патогенный фактор;
- при определенной массе некротизированных тканей появляются биологически активные вещества, включающие различные интегративные механизмы регуляции воспаления, в том числе и реактанты острой фазы, и систему фибробластов;
- способствует активации иммунной системы, которая регулирует утилизацию измененных «своих» тканей.
ПРОДУКТИВНАЯ (ПРОЛИФЕРАТИВНАЯ) СТАДИЯ
Продуктивная (пролиферативная) стадия завершает острое воспаление и обеспечивает репарацию (восстановление) поврежденных тканей. В эту стадию происходят следующие процессы:
- уменьшается воспаленной ткани;
- снижается интенсивность эмиграции форменных элементов крови;
- уменьшается количество лейкоцитов в зоне воспаления;
- очаг воспаления постепенно заполняют макрофаги гематогенного происхождения, которые выделяют интерлейкины — хемоаттрактанты для фибробластов и стимулирующие, кроме того, новообразование сосудов;
- происходит размножение в очаге воспаления фибробластов:
- скопление в очаге воспаления клеток иммунной системы — Т- и В-лимфоцитов, плазмоцитов;
- образование воспалительного инфильтрата — скопление указанных клеток при резком уменьшении жидкой части экссудата;
- активация анаболических процессов — интенсивности синтеза ДНК и РНК, основного вещества и фибриллярных структур соединительной ткани:
- «очищение» поля воспаления за счет активации гидролаз лизосом моноцитов, макрофагов, гистиоцитов и других клеток;
- пролиферация эндотелиоцитов сохранившихся сосудов и образование новых сосудов:
- формирование грануляционной ткани после ликвидации некротического детрита.
Грануляционная ткань — незрелая соединительная ткань, характеризующаяся скоплением клеток воспалительного инфильтрата и особой архитектоникой вновь образованных сосудов, растущих вертикально до поверхности повреждения, а затем вновь опускающихся в глубину. Участок поворота сосудов выглядит как гранула, что и дало название ткани. По мере очищения очага воспаления от некротических масс грануляционная ткань заполняет всю зону повреждения. Она обладает большой резорбционной способностью, но в то же время представляет собой барьер для возбудителей воспаления.
Воспалительный процесс заканчивается созреванием грануляций и образованием зрелой соединительной ткани.
ФОРМЫ ОСТРОГО ВОСПАЛЕНИЯ
Клинико-анатомические формы воспаления определяются по преобладанию в его динамике либо экссудации, либо пролиферации над другими реакциями, составляющими воспаление. В зависимости от этого выделяют:
- экссудативное воспаление;
- продуктивное (или пролиферативное) воспаление.
По течению различают:
- острое воспаление — длится не более 4—6 нед;
- хроническое воспаление — длится более 6 нед, вплоть до нескольких месяцев и лет.
По патогенетической специфике выделяют:
- обычное (банальное) воспаление;
- иммунное воспаление.
ЭКССУДАТИВНОЕ ВОСПАЛЕНИЕ
Экссудативное воспаление характеризуется образованием экссудатов, состав которых определяется главным образом:
- причиной воспаления;
- ответной реакцией организма на повреждающий фактор и его особенности;
- экссудат определяет и название формы экссудативного воспаления.
1. Серозное воспаление характеризуется образованием серозного экссудата — мутноватой жидкости, содержащей до 2—25 % белка и небольшое количество клеточных элементов — лейкоцитов, лимфоцитов, слущенных эпителиальных клеток.
Причинами серозного воспаления являются:
- действие физических и химических факторов (например, отслоение эпидермиса с образованием пузыря при ожоге);
- действие токсинов и ядов, вызывающих резкую плазморрагию (например, пустулы на коже при натуральной оспе):
- выраженная интоксикация, сопровождающаяся гиперреактивностью организма, что вызывает серозное воспаление в строме паренхиматозных органов — так называемое межуточное воспаление.
Локализация серозного воспаления — слизистые и серозные оболочки, кожа, интерстициальная ткань, клубочки почек, пери-синусоидальные пространства печени.
Исход обычно благоприятный — экссудат рассасывается и структура поврежденных тканей восстанавливается. Неблагоприятный исход связан с осложнениями серозного воспаления» например, серозный экссудат в мягких мозговых оболочках (серозный лептоменингит) может сдавливать головной мозг, серозное пропитывание альвеолярных септ легких является одной из причин острой дыхательной недостаточности. Иногда после серозного воспаления в паренхиматозных органах развивается диффузный склероз их стромы.
2. Фибринозное воспаление характеризуется образованием фибринозного экссудата, содержащего, помимо лейкоцитов, моноцитов, макрофагов, распадающихся клеток воспаленной ткани большое количество фибриногена, который выпадает в виде свертков фибрина. Поэтому в фибринозном экссудате содержание белка составляет 2,5—5 %.
Причинами фибринозного воспаления может быть разнообразная микробная флора: токсигенные коринебактерии дифтерии, различные кокки, микобактерии туберкулеза, некоторые шигеллы — возбудители дизентерии, эндогенные и экзогенные токсические факторы и др.
Локализация фибринозного воспаления — слизистые и серозные оболочки.
Морфогенез.
Экссудации предшествует некроз ткани и агрегация тромбоцитов в очаге воспаления. Фибринозный экссудат пропитывает мертвые ткани, образуя светло-серую пленку, под которой располагаются микробы, выделяющие токсины. Толщина пленки определяется глубиной некроза, а сама глубина некроза зависит от структуры эпителиальных или серозных покровов и особенностей подлежащей соединительной ткани. Поэтому в зависимости от глубины некроза и толщины фибринозной пленки выделяют 2 вида фибринозного воспаления: крупозное и дифтеритическое.
Крупозное воспаление в виде тонкой, легко снимающейся фибринозной пленки развивается на однослойном эпителиальном покрове слизистых или серозных оболочек, расположенных на тонкой плотной соединительнотканной основе.
После снятия фибринозной пленки не образуется дефекта подлежащих тканей. Крупозное воспаление развивается на слизистой оболочке трахеи и бронхов, на эпителиальной выстилке альвеол, на поверхности плевры, брюшины, перикарда при фибринозном трахеите ибронхите, крупозной пневмонии, перитоните, перикардите и т. п. (рис. 24).
Дифтеритическое воспаление, развивающееся на поверхностях, выстланных плоским или переходным эпителием, а также другими видами эпителия, расположенными на рыхлой и широкой соединительнотканной основе. Такая структура ткани обычно способствует развитию глубокого некроза и образованию толстой, трудно снимающейся фибринозной пленки, после удаления которой остаются язвы. Дифтеритическое воспаление развивается в зеве, на слизистых оболочках пищевода, желудка, кишечника, матки и влагалища, мочевого пузыря, в ранах кожи и слизистых оболочек.
Исход фибринозного воспаления может быть благоприятным: при крупозном воспалении слизистых оболочек фибринозные пленки расплавляются под влиянием гидролаз лейкоцитов и на их месте восстанавливается исходная ткань. Дифтеритическое воспаление заканчивается образованием язв, которые иногда могут заживать с образованием рубцов. Неблагоприятным исходом фибринозного воспаления является организация фибринозного экссудата, образование спаек и шварт между листками серозных полостей вплоть до их облитерации, например полости перикарда, плевральных полостей.
3. Гнойное воспаление характеризуется образованием гнойного экссудата, который представляет собой сливкообразную массу, состоящую из детрита тканей очага воспаления, дистрофически измененных клеток, микробов, большого количества форменных элементов крови, основную массу которых составляют живые и погибшие лейкоциты, а также лимфоцитов, моноцитов, макрофагов, часто эозинофильных гранулоцитов. Содержание белка в гное составляет 3—7 %. pH гноя 5.6—6.9. Гной имеет специфический запах, синевато-зеленоватую окраску с различными оттенками. Гнойный экссудат обладает рядом качеств, определяющих биологическую значимость гнойного воспаления; содержит различные ферменты, в том числе протеазы, расщепляющие погибшие структуры, поэтому в очаге воспаления характерен лизис тканей; содержит наряду с лейкоцитами, способными фагоцитировать и убивать микробы, различные бактерицидные факторы — иммуноглобулины, компоненты комплемента, белки и др. Поэтому гной задерживает рост бактерий и уничтожает их. Через 8— 12 ч лейкоциты гноя погибают, превращаясь в «гнойные тельца».
Причиной гнойного воспаления являются гноеродные микробы — стафилококки, стрептококки, гонококки, брюшнотифозная палочка и др.
Локализация гнойного воспаления — любые ткани организма и все органы.
Формы гнойного воспаления.
Абсцесс — отграниченное гнойное воспаление, сопровождающееся образованием полости, заполненной гнойным экссудатом. Полость ограничена пиогенной капсулой — грануляционной тканью, через сосуды которой поступают лейкоциты. При хроническом течении абсцесса в пиогенной мембране образуются два слоя: внутренний, состоящий из грануляционной ткани, и наружный, образующийся в результате созревания грануляционной ткани в зрелую соединительную ткань. Абсцесс обычно заканчивается опорожнением и выходом гноя на поверхность тела, в полые органы или полости через свищ — канал, выстланный грануляционной тканью или эпителием, соединяющий абсцесс с поверхностью тела или с его полостями. После прорыва гноя полость абсцесса рубцуется. Изредка абсцесс подвергается инкапсуляции.
Флегмона — неотграниченное, диффузное гнойное воспаление, при котором гнойный экссудат пропитывает и расслаивает ткани. Флегмона обычно образуется в подкожной жировой клетчатке, межмышечных прослойках и т. п. Флегмона может быть мягкой, если преобладает лизис некротизированных тканей, и твердой, когда во флегмоне возникает коагуляционный некроз тканей, которые постепенно отторгаются. В некоторых случаях гной может стекать под влиянием силы тяжести в нижележащие отделы по ходу мышечно-сухожильных влагалищ, нервно-сосудистых пучков, жировых прослоек и образовывать вторичные, так называемые холодные абсцессы, или натечники. Флегмонозное воспаление может распространяться на сосуды, вызывая тромбоз артерий и вен (тромбофлебиты, тромбартерииты, лимфангииты). Заживление флегмоны начинается с ее ограничения с последующим образованием грубого рубца.
Эмпиема — гнойное воспаление полостей тела или полых органов. Причиной эмпиемы являются как гнойные очаги в соседних органах (например, абсцесс легкого и эмпиема плевральной полости), так и нарушение оттока гноя при гнойном воспалении полых органов — желчного пузыря, червеобразного отростка, маточной трубы и т. д. При длительном течении эмпиемы происходит облитерация полого органа или полости.
Гнойная рана — особая форма гнойного воспаления, которая возникает либо вследствие нагноения травматической, в том числе хирургической, раны, либо в результате вскрытия во внешнюю среду очага гнойного воспаления и образования раневой поверхности, покрытой гнойным экссудатом.
4. Гнилостное, или ихорозное, воспаление развивается при попадании гнилостной микрофлоры в очаг гнойного воспаления с выраженным некрозом тканей. Обычно возникает у ослабленных больных с обширными, длительно не заживающими ранами или хроническими абсцессами. При этом гнойный экссудат приобретает особо неприятный запах гниения. В морфологической картине превалирует некроз тканей без склонности к отграничению. Некротизированные ткани превращаются в зловонную массу, что сопровождается нарастающей интоксикацией.
5. Геморрагическое воспаление является формой серозного, фибринозного или гнойного воспаления и характеризуется особо высокой проницаемостью сосудов микроциркуляции, диапедезом эритроцитов и их примесью к уже имеющемуся экссудату (серозно-геморрагическое, гнойно-геморрагическое воспаление). Примесь эритроцитов в результате превращений гемоглобина придает экссудату черный цвет.
Причиной геморрагического воспаления обычно является очень высокая интоксикация, сопровождающаяся резким повышением проницаемости сосудов, что наблюдается, в частности, при таких инфекциях, как чума, сибирская язва, при многих вирусных инфекциях, натуральной оспе, при тяжелых формах гриппа и др.
Исход геморрагического воспаления обычно зависит от его этиологии.
6. Катаральное воспаление развивается на слизистых оболочках и характеризуется примесью слизи к любому экссудату, поэтому оно, как и геморрагическое, не является самостоятельной формой воспаления.
Причиной катарального воспаления могут быть различные инфекции. продукты нарушенного метаболизма, аллергические раздражители, термические и химические факторы. Например, при аллергическом рините слизь примешивается к серозному экссудату (катаральный ринит), нередко наблюдается гнойный катар слизистой оболочки трахеи и бронхов (гнойно-катаральный трахеит или бронхит) и т. п.
Исход. Острое катаральное воспаление продолжается 2—3 нед и, заканчиваясь, не оставляет следов. Хроническое катаральное воспаление может привести к атрофическим или гипертрофическим изменениям слизистой оболочки.
ПРОДУКТИВНОЕ ВОСПАЛЕНИЕ
Продуктивное (пролиферативное) воспаление характеризуется преобладанием пролиферации клеточных элементов над экссудацией иальтерацией. Выделяют 4 основные формы продуктивного воспаления:
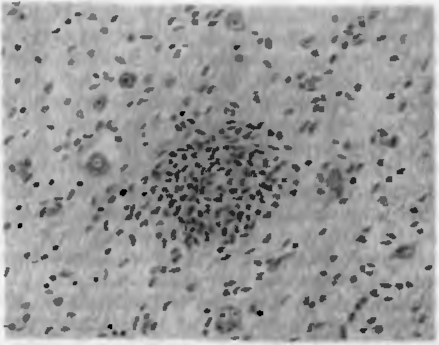
Рис. 25. Сыпнотифозная гранулема Попова. Скопление гистиоцитов и глиальных клеток на месте разрушенного сосуда.
1. Гранулематозное воспаление может протекать остро и хронически, однако наибольшее значение имеет хроническое течение процесса.
Острое гранулематозное воспаление наблюдается, как правило, при острых инфекционных заболеваниях — сыпном тифе, брюшном тифе, бешенстве, эпидемическом энцефалите, остром переднем полиомиелите и др. (рис. 25).
Патогенетической основой острого гранулематозного воспаления обычно является воспаление сосудов микроциркуляции при воздействии инфекционных агентов или их токсинов, что сопровождается ишемией периваскулярной ткани.
Морфология острого гранулематозного воспаления. В нервной ткани морфогенез гранулем определяется некрозом группы нейронов или ганглиозных клеток, а также мелкоочаговыми некрозами вещества головного или спинного мозга, окруженными глиальными элементами, несущими функцию фагоцитов.
При брюшном тифе морфогенез гранулем обусловлен скоплением фагоцитов, трансформировавшихся из ретикулярных клеток в групповых фолликулах тонкой кишки. Эти крупные клетки фагоцитируют S. typhi, а также детрит, образующийся в соли-тарных фолликулах. Тифозные гранулемы подвергаются некрозу.
Исход острого гранулематозного воспаления может быть благоприятным, когда гранулема исчезает без следа, как при брюшном тифе, или после нее остаются небольшие глиальные рубчики, как при нейроинфекциях. Неблагоприятный исход острого гранулематозного воспаления связан в основном с его осложнениями — перфорацией кишки при брюшном тифе либо с гибелью большого количества нейронов с тяжелыми последствиями.
2. Интерстициальное диффузное, или межуточное, воспаление локализуется в строме паренхиматозных органов, где происходит накопление мононуклеаров — моноцитов, макрофагов, лимфоцитов. В паренхиме при этом развиваются дистрофические и некробиотические изменения.
Причиной воспаления могут быть либо различные инфекционные агенты, либо оно может возникать как реакция мезенхимы органов на токсические воздействия или микробную интоксикацию. Наиболее яркая картина межуточного воспаления наблюдается при интерстициальной пневмонии, межуточном миокардите, интерстициальных гепатите и нефрите.
Исход интерстициального воспаления может быть благоприятным, когда происходит полное восстановление межуточной ткани органов и неблагоприятным, когда строма органа склерозируется, что обычно происходит при хроническом течении воспаления.
3. Гиперпластические (гиперрегенераторные) разрастания — продуктивное воспаление в строме слизистых оболочек, при котором происходит пролиферация клеток стромы. сопровождающаяся скоплением эозинофилов, лимфоцитов, а также гиперплазией эпителия слизистых оболочек. При этом образуются полипы воспалительного происхождения — полипозный ринит, полипозный колит и т. п.
Гиперпластические разрастания возникают также на границе слизистых оболочек с плоским или призматическим эпителием в результате постоянного раздражающего действия отделяемого слизистых оболочек, например, прямой кишки или женских половых органов. При этом эпителий мацерируется, а в строме возникает хроническое продуктивное воспаление, приводящее к образованию остроконечных кондилом.
4. Воспаление вокруг животных паразитов и инородных тел характеризуется продуктивной воспалительной реакцией, направленной на отграничение раздражителей от окружающих тканей путем образования вокруг них соединительнотканной капсулы, т. е. они не могут быть фагоцитированы и элиминированы. Поэтому вокруг инородных тел. например осколка снаряда, образуется грануляционная ткань и инфильтрат из фибробластов, лимфоцитов, макрофагов и гигантских клеток инородных тел. Некоторые инородные тела (например, остатки шовного материала после операции) могут быть ликвидированы в динамике продуктивного воспаления с помощью макрофагов и гигантских клеток. При воспалении вокруг животных паразитов (трихинелл, цистицерков, эхинококков и др.) к указанному инфильтрату добавляются эозинофильные гранулоциты.
Исходом воспаления может быть образование рубца; погибшие животные паразиты нередко петрифицируются.
ИММУННОЕ ВОСПАЛЕНИЕ
Иммунное воспаление — вид воспаления, причиной которого первоначально является реакция иммунной системы. Это понятие ввел А. И. Струков (1979), который показал, что морфологической основой реакций гиперчувствительности немедленного типа(анафилаксия, феномен Артюса и др.), а также гиперчувствительности замедленного типа(туберкулиновая реакция) является воспаление. В связи с этим и пусковым механизмом такого воспаления становится повреждение тканей иммунными комплексами антиген—антитело, компонентами комплемента и ряда медиаторов иммунитета.
При реакции гиперчувствительности немедленного типа эти изменения развиваются в определенной последовательности:
- образование иммунных комплексов антиген—антитело в просветах венул:
- связывание этих комплексов с комплементом;
- хемотаксическое действие иммунных комплексов на ПЯЛ и скопление их около вен и капилляров;
- фагоцитоз и переваривание иммунных комплексов лейкоцитами;
- повреждение иммунными комплексами и лизосомами лейкоцитов стенок сосудов, с развитием в них фибриноидного некроза, периваскулярных кровоизлияний и отека окружающих тканей.
В результате в зоне иммунного воспаления развивается экссудативно-некротическая реакция с серозно-геморрагическим экссудатом
При реакции гиперчувствительности замедленного типа, которая развивается в ответ на находящийся в тканях антиген, последовательность процессов несколько иная:
- Т-лимфоциты и макрофаги выселяются в ткань, находят антиген и уничтожают его, разрушая при этом и ткани, в которых находится антиген;
- в зоне воспаления скапливается лимфомакрофагальный инфильтрат, нередко с гигантскими клетками и небольшим количеством ПЯЛ;
- изменения микроциркуляторного русла выражены слабо;
- это иммунное воспаление протекает по типу продуктивного, чаще всего гранулематозного, иногда межуточного и характеризуется затяжным течением.
ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ
Хроническое воспаление — патологический процесс, характеризующийся персистенцией патологического фактора, развитием в связи с этим иммунологической недостаточности, что обусловливает своеобразие морфологических изменений тканей в области воспаления, течение процесса по принципу порочного круга, затруднение репарации и восстановления гомеостаза.
По существу хроническое воспаление является проявлением возникшего дефекта в системе защиты организма кизменившимся условиям его существования.
Причиной хронического воспаления является в первую очередь постоянное действие (персистенция) повреждающего фактора, которое может быть связано как с особенностями этого фактора (например, устойчивость против гидролаз лейкоцитов), так и с недостаточностью механизмов воспаления самого организма (патологией лейкоцитов, угнетением хемотаксиса, нарушением иннервации тканей или их аутоиммунизацией и т. п.).
Патогенез. Персистенция раздражителя постоянно стимулирует иммунную систему, что приводит к ее срыву и появлению на определенном этапе воспаления комплекса иммунопатологических процессов, прежде всего появление и нарастание иммунодефицита, иногда также к аутоиммунизации тканей, и этот комплекс уже сам обусловливает хронизацию воспалительного процесса.
У больных развивается лимфоцитопатия, в том числе снижается уровень Т-хелперов и Т-супрессоров, нарушается их соотношение, одновременно повышается уровень образования антител, увеличивается концентрация в крови циркулирующих иммунных комплексов (ЦИК), комплемента, что приводит к повреждению сосудов микроциркуляции и развитию васкулитов. При этом снижается способность организма к выведению иммунных комплексов. Падает также способность лейкоцитов к хемотаксису из-за накопления в крови продуктов распада клеток, микробов, токсинов, иммунных комплексов, особенно при обострении воспаления.
Морфогенез. Зона хронического воспаления обычно заполнена грануляционной тканью со сниженным числом капилляров. Характерны продуктивные васкулиты, а при обострении процесса васкулиты носят гнойный характер. В грануляционной ткани множественные очаги некроза, лимфоцитарный инфильтрат, умеренное количество нейтрофильных лейкоцитов, макрофагов и фибробластов, содержатся также иммуноглобулины. В очагах хронического воспаления нередко обнаруживаются микробы, но при этом остается сниженным количество лейкоцитов и их бактерицидная активность. Нарушены также и регенераторные процессы — мало эластических волокон, в формирующейся соединительной ткани преобладает нестойкий коллаген III типа, мало коллагена IV типа, необходимого для построения базальных мембран.
Общим признаком хронического воспаления является нарушение циклического течения процесса в виде постоянного наслаивания одной стадии на другую, прежде всего стадий альтерации и экссудации на стадию пролиферации. Это ведет к постоянным рецидивам и обострениям воспаления и невозможности репарации поврежденных тканей и восстановления гомеостаза.
Этиология процесса, особенности структуры и функции органа, в котором развивается воспаление, реактивность и другие факторы накладывают отпечаток на течение и морфологию хронического воспаления. Поэтому клинические и морфологические проявления хронического воспаления разнообразны.
Хроническое гранулематозное воспаление развивается в тех случаях, когда организм не может уничтожить патогенный агент, но в то же время имеет возможность ограничить его распространение, локализовать в определенных участках органов и тканей. Наиболее часто оно возникает при инфекционных заболеваниях, таких как туберкулез, сифилис, лепра, сап и некоторые другие, которые имеют ряд общих клинических, морфологических и иммунологических особенностей. Поэтому такое воспаление нередко называют специфическим воспалением.
По этиологии выделяют 3 группы гранулем:
- инфекционные, такие как гранулемы при туберкулезе, сифилисе, актиномикозе, сапе и др.;
- гранулемы инородных тел — крахмальные, тальковые, шовные и др.;
- гранулемы неизвестной природы, например при саркоидозе. эозинофильные, аллергические и др.
Морфология. Гранулемы представляют собой компактное скопление макрофагов и/или эпителиоидных клеток, обычно гигантских многоядерных клеток типа Пирогова—Лангханса или типа инородных тел. По преобладанию тех или иных типов макрофагов выделяют гранулемы макрофагальные (рис. 26) и эпитпелюидноклеточные (рис. 27). Оба типа гранулем сопровождаются инфильтрацией другими клетками — лимфоцитами, плазматическими, нередко нейтрофильными или эозинофильными лейкоцитами. Характерны также наличие фибробластов и развитие склероза. Часто в центре гранулем возникает казеозный некроз.
Иммунная система принимает участие в образовании хронических инфекционных гранулем и большинства гранулем неизвестной этиологии, поэтому такое фанулематозное воспаление обычно сопровождается клеточно-опосредованным иммунитетом, в частности ГЗТ.
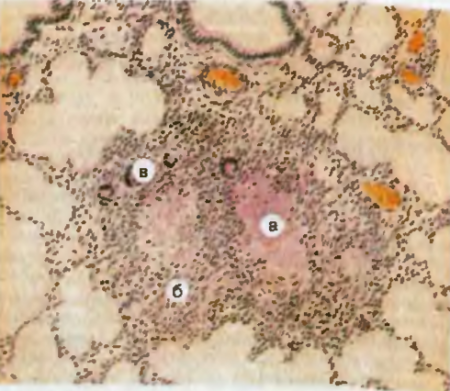
Рис. 27. Туберкулезные узелки (гранулемы) в легких. Казеозный некроз центральной части гранулем (а); на границе с фокусами некоза эпителиоидные клетки (б) и гигантские клетки Пирогова—Лангханса (в) периферии гранулем скопления лимфоидных клеток.
Исходы гранулематозного воспаления, которое, как и всякое другое, протекает циклически:
- рассасывание клеточного инфильтрата с образованием рубца на месте бывшего инфильтрата;
- обызвествление гранулемы (например, очаг Гона при туберкулезе);
- прогрессирование сухого (казеозного) некроза или влажного некроза с образованием дефекта тканей — каверны;
- рост гранулемы вплоть до образования псевдоопухоли.
Гранулематозное воспаление лежит в основе гранулематозных болезней, т. е. таких заболеваний, в которых это воспаление представляет собой структурно-функциональную основу заболевания. Примером гранулематозных заболеваний являются тубекулез, сифилис, лепра, сап и др.
Таким образом, все изложенное позволяет считать воспаление типовой и вместе с тем уникальной реакцией организма, имею щей приспособительный характер, но в зависимости от индивидуальных особенностей больного оно может утяжелять его со стояние, вплоть до развития смертельных осложнений. В связи с этим воспаление, особенно составляющее основу различных заболеваний, требует лечения.