Регуляция кислотно-основного состояния
Регуляция pH жидкостей организма.
Основные сведения.
Все клетки организма окружены жидкой средой, называемой внеклеточной жидкостью, химический состав которой поддерживается в узких пределах, что обеспечивает оптимальные условия для поддержания нормальной работы клеток и является одним из важнейших показателей гомеостаза. Например, внеклеточная концентрация ионов К— находится в пределах от 3.5 до 5,0 нэкв/л (наноэквивалент — нэкв — это 10-9 экв). Отклонение от нормальной концентрации калия в сыворотке крови может вызвать нарушение передачи нервных импульсов, электрической проводимости сердца, нарушение сократимости скелетной, сердечной и гладкой мускулатуры.
Во внеклеточной жидкости тонко регулируется концентрация ионов Н+, в норме составляющая от 3 до 47 нэкв/л. Образовавшиеся ионы водорода (Н+) быстро реагируют с молекулами воды, образуя ионы гидроксония (Н3O+), обеспечивающие кислотность жидкостей организма. Отклонение от нормальной концентрации ионов Н+ вызывает нарушение клеточного метаболизма, вследствие изменений трехмерной пространственной структуры и активности ферментов, гормонов и других химических регуляторов клеточных функций. При этом возможно нарушение нормального распределения ионов натрия и калия между внутри- и внеклеточной жидкостью, что в свою очередь вызовет изменение таких функций клеток и тканей, как проводимость, сократимость и секреция.
Таким образом, поддержание нормальной концентрации ионов Н+ во внеклеточной жидкости необходимо для функционирования организма. Концентрация ионов Н+ определяется видом и количеством кислот и оснований. Поэтому регуляция содержания ионов Н+ в организме носит название кислотно-основного состояния (КОС). Водородный показатель pH (от англ. power Hydrogen — сила водорода) — это отрицательный десятичный логарифм концентрации ионов водорода (Н+) в растворе. Один литр воды при температуре 225 °С содержит 0,0000001 ионов Н+, т.е. 10-7. Значение pH растворов уменьшается при увеличении концентрации ионов Н+. При добавлении ионов Н+ раствор становится более кислым, а значение pH падает ниже 7,0.
Щелочные (или основные) растворы имеют меньшую концентрацию ионов Н+, и значение pH будет в пределах от 7 до 14. Чем меньше концентрация ионов Н+, тем более щелочной раствор. Соотношение между pH и концентрацией ионов Н+ имеет логарифмическую, а не линейную зависимость, т.е. увеличение или уменьшение pH соответствует десятикратному изменению концентрации ионов Н+.
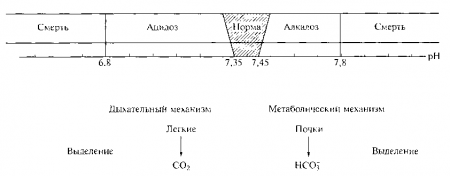
Во внеклеточных жидкостях организма человека допустимые значения pH находятся в пределах от 7,35 до 7,45. Далее приведены нормальные значения содержания газов в крови:
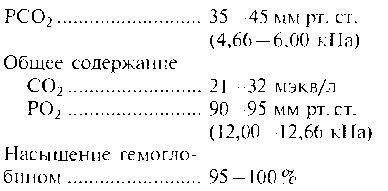
Уровень pH ниже 7,35 отражает закисление (ацидоз), тогда как уровень pH выше 7,45 — защелачивание (алкалоз). При концентрации ионов Н+ 40 нэкв/л pH составляет 7,40. Такая величина pH внеклеточной (интерстициальной) жидкости и плазмы крови создает оптимальные условия для нормального функционирования клеток человеческого организма.
Для млекопитающих совместимая с жизнью концентрация ионов Н+ во внеклеточных жидкостях находится в больших пределах, от 16 до 125 нэкв/л, что соответствует величине pH от 6,8 до 7,8.
Изменение концентрации ионов Н+ в плазме изменяет функционирование многих ферментных и гормональных систем.
В процессе клеточного метаболизма непрерывно образуются кислоты. Избыток ионов Н+ постоянно выводится из организма для поддержания устойчивого состояния. Образуются кислоты двух типов: летучие, которые удаляются легкими, и нелетучие, которые выводятся через почки. Концентрация ионов Н+ зависит и от содержания его акцепторов — оснований.
И кислоты, и щелочи являются электролитами. К ним относятся вещества, которые при взаимодействии с водой диссоциируют и образуют ионы: катионы (положительно заряженные электролиты, например, натрий) и анионы (отрицательно заряженные электролиты, например, хлориды). Растворы ионов легко проводят электрический ток, поэтому и называются электролитами.
Кислоты — это электролиты, которые диссоциируют в воде с образованием положительно заряженных катионов и отрицательно заряженных анионов. Кислоты являются источником ионов водорода Н+. При добавлении кислот в растворы увеличивается концентрация ионов Н+. Кислоты различаются по степени диссоциации в воде: сильные кислоты полностью диссоциируют и быстро освобождают ионы Н+. Соляная кислота (НС1) является сильной кислотой, так как 99,9 % ее молекул ионизируется в чистой воде. Слабые кислоты в воде ионизируются частично и, следовательно, не высвобождают ионы Н+ так же быстро, как сильные кислоты. Летучие кислоты могут быть выведены из организма, как газы. Для этого сама кислота либо ее химический продукт превращается в газообразные вещества и экскретируется легкими. Угольная кислота (Н2СO3), образующаяся путем гидратации диоксида углерода (СO2) в жидкостях организма, является летучей кислотой. Реакция выражается формулой:
![]()
Карбоангидраза ускоряет реакцию. У здорового взрослого человека образуется около 300 л диоксида углерода в сутки в результате метаболических реакций. Это ведет к образованию около 13 000 нэкв водородных ионов уголь-
ной кислоты, что эквивалентно литру концентрированной соляной кислоты. В норме легкие выводят углекислый газ по мере образования, поэтому угольная кислота не накапливается в организме и не сдвигает pH внеклеточной жидкости. Образующийся из угольной кислоты анион гидрокарбоната НСО3 нейтрализуется катионами Na+ и К+.
Нелетучие кислоты не могут быть удалены через легкие, а выводятся через почки. Все метаболические кислоты, присутствующие в жидкостях организма, кроме угольной кислоты, — нелетучие и включают фосфорную, молочную кислоты, кетокислоты (ацетоуксусная, β-гидроксимасляная, пировиноградная) и небольшое количество других органических и неорганических кислот.
Некоторая часть нелетучих кислот нейтрализуется нелетучими основаниями пиши. Например, фрукты и овощи содержат такие щелочные вещества. как нитрат калия. При избытке в пище нелетучих кислот или оснований они должны быть выведены из организма через почки для обеспечения регуляции оптимального значения pH внеклеточных жидкостей.
Основания — это вещества, способные связывать ионы Н+. Чем сильнее основания, тем быстрее они связывают ионы Н—.
Гидроксиды, такие как гидроксид натрия (NaOH), который содержит ион гидроксила (ОН+). являются сильными основаниями. Слабые основания связывают ионы Н+ менее прочно. Гидрокарбонат натрия (NaHC03) обладает слабощелочными свойствами.
При взаимодействии с водой гидрокарбонат натрия полностью диссоциирует. Небольшое количество ионов гидрокарбоната связывают ионы Н+ и образуют углекислоту:![]()
![]() Так как основания являются акцепторами ионов Н+ добавление оснований в раствор, содержащий ионы Н+, снижает их концентрацию; обратная картина наблюдается при добавлении кислоты.
Так как основания являются акцепторами ионов Н+ добавление оснований в раствор, содержащий ионы Н+, снижает их концентрацию; обратная картина наблюдается при добавлении кислоты.
Регуляция pH внеклеточной жидкости в норме поддерживается в пределах от 7.35 до 7,45, что в основном обеспечивается тремя интегрированными механизмами: химическими буферными системами, респираторной системой регуляции концентрации углекислого газа и регуляцией почка ми концентрации гидрокарбоната в плазме.
Химическая буферная система.
Химические буферные системы образуют первую линию зашиты от изменений pH жидкости организма. Они осуществляют немедленную защиту от резкого увеличения или уменьшения концентрации ионов Н+. Химический буфер является смесью двух или более веществ, благодаря которым уменьшаются изменения pH раствора при добавлении кислоты или основания. Это происходит путем отнятия ионов Н+ при поступлении кислоты или путем освобождения ионов Н+, когда pH повышается. Функция буферов состоит в том, чтобы превращать сильные кислоты, которые вызывают значительный сдвиг pH. в слабые, незначительно влияющие на pH, а также в том. чтобы превращать сильные основания в слабые.
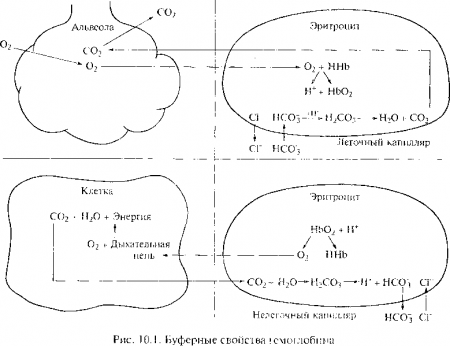
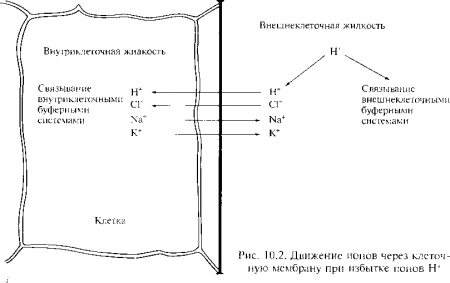
Химические буферы в жидкостях организма состоят из слабой кислоты и солей их оснований, вместе образуя кислотно-щелочную буферную пару. Во внеклеточных жидкостях наиболее важными являются соли натрия, во внутриклеточных — соли калия. Химические буферные пары включают бикарбонатные. фосфатные и белковые буферные системы. Бикарбонатная система уменьшает сдвиг pH, создаваемый летучими и нелетучими кислотами в интерстициальной жидкости и в плазме. На рис. 10.1 показано, как в легочных капиллярах с помощью гемоглобина удаляется диоксид углерода из организма, а в нелегочных капиллярах он захватывается из тканей. Воздействие химических буферных систем на образование и метаболизм кислот происходит внутриклеточно и внеклеточно и в интерстициальной жидкости, и в крови. Но большинство этих реакций происходит внутри клеток, так как при поступлении кислоты или основания во внеклеточную жидкость приблизительно половина ионов диффундирует в клетки, где они подвергаются воздействию буферных систем, которые влияют на кислотно-основное равновесие (КОР), обмениваются через клеточную мембрану на внутриклеточные ионы или поступают в клетки с ионами противоположного заряда (рис. 10.2). Например, если кислота поступает во внеклеточную жидкость, некоторые ионы Н+ связываются химическими буферами во внеклеточной жидкости, а другая часть ионов диффундирует через клеточную мембрану в клетки. Так как водородные ионы заряжены положительно, они могут либо обменяться через клеточную мембрану на другие ионы, такие как ионы Na+ и К+, либо поступить в клетку с анионом, таким как Сl—. Хотя идут оба эти процесса, в количественном отношении более важным является движение катионов из клетки. При метаболическом ацидозе, например, уровень внеклеточного калия, определяемый по его концентрации в плазме крови, часто повышается. Тогда внутриклеточные запасы калия истощаются вследствие обмена с ионами Н+ через мембрану клетки. Часто при метаболическом ацидозе также уменьшается содержание хлоридов плазмы.
Бикарбонатная система является наиболее важным внеклеточным буфером, так как она может регулировать величину pH как через легкие, так и через почки. Система представлена угольной кислотой и гидрокарбонатом натрия (калия), имеющими общий ион НСО3. Этот ион в основном образуется при диссоциации гидрокарбоната и подавляет диссоциацию слабой угольной кислоты, которая легко диссоциирует:
![]()
В норме соотношение «угольная кислота (Н2СО3)/бикарбонат (НСО3)» поддерживается приблизительно на уровне 1: 20. Это соотношение поддерживает pH на уровне 7,4, для которого требуется сохранение баланса 1,2 ммоль/л Н2СО3 к 24 ммоль/л ионов НСО3, т.е. 1:20. Пока такое соотношение поддерживается, pH остается стабильным. Например, если в организме происходит задержка диоксида углерода и соответствующее компенсаторное удерживание бикарбоната, то количество угольной кислоты может составлять 2,0 ммоль/л и ионов НСО3 — 40 пэкв/л, тогда соотношение становится 2:40 вместо 1:20 и, следовательно, pH остается 7,4. Дыхательная система очень быстро выделяет или удерживает диоксид углерода, тогда как почки работают более медленно для удержания или выведения ионов НСО3. Механизм действия бикарбонатной системы заключается в следующем. При поступлении избытка кислот (ионы Н+) они нейтрализуются щелочным компонентом буфера с образованием слабой углекислоты.
Образовавшийся затем углекислый газ возбуждает дыхательный центр, и весь его избыток удаляется из крови с выдыхаемым воздухом. Бикарбонатный буфер способен нейтрализовать и избыток оснований, которые будут связаны углекислотой с образованием и последующим выделением гидрокарбоната натрия (NaHCО3) почками. В результате pH изменяется незначительно. Эффективность бикарбонатной системы более высокая, если pH ниже нормы, т.е. имеется ацидотический сдвиг.
В крови и особенно в тканях важная роль принадлежит фосфатному буферу. Фосфатная буферная система является главным внутриклеточным буфером для противодействия метаболическим кислотам. Роль кислоты в этом буфере выполняет дигидрофосфат натрия (NaH2PО4), роль основания — гидрофосфат натрия (Na2HPО4). Принцип действия фосфатного буфера аналогичен бикарбонатному. Этот буфер имеет большое значение в почечной регуляции кислотно-щелочного гомеостаза. В крови его действие в основном сводится к поддержанию постоянства и воспроизводству карбонатного буфера. Избыток кислот вызывает в системе, содержащей карбонатный и фосфатный буферы, увеличение концентрации угольной кислоты и уменьшение гидрокарбоната натрия. Далее, благодаря одновременному присутствию в растворе фосфатного буфера и угольной кислоты, происходит обменная реакция:
![]() т.е. избыток угольной кислоты устраняется, а концентрация гидрокарбоната натрия увеличивается. К другим химическим буферным системам относятся также внутриклеточные органические фосфаты, такие как АТФ, АДФ, КФ, а также кристаллы гидроксиапатита (в костной и зубной ткани).
т.е. избыток угольной кислоты устраняется, а концентрация гидрокарбоната натрия увеличивается. К другим химическим буферным системам относятся также внутриклеточные органические фосфаты, такие как АТФ, АДФ, КФ, а также кристаллы гидроксиапатита (в костной и зубной ткани).
Белковый буфер представляет собой белки плазмы, гемоглобин и белки внутриклеточной жидкости. Они могут реагировать как с летучими, так и с нелетучими кислотами. Из белков крови наиболее мощной буферной системой является гемоглобин, константа диссоциации кислотных групп которого зависит от его насыщения кислородом. Окисленная форма гемоглобина является более сильной кислотой, и она увеличивает поступление из эритроцитов в плазму ионов Н+. Восстановленная форма гемоглобина является более слабой кислотой, и она обладает способностью связывать большое количество ионов Н+.
В сосудах микроциркуляторного русла большого круга кровообращения окисленный гемоглобин отдает кислород в ткани, и в эритроциты поступает углекислый газ, который под влиянием карбоангидразы взаимодействует с водой и образуется угольная кислота, которая диссоциирует, а образующиеся ионы Н+ соединяются с гемоглобином.
Оставшиеся ионы НСО3 выходят в плазму, из которой в эритроциты поступают ионы Сl—, при этом ионы Na+ остаются в плазме, а ионы НСO3 восстанавливают в этих микрососудах щелочной резерв плазмы. В капиллярах легких, т.е. в малом круге кровообращения, происходит выделение углекислого газа благодаря переходу гемоглобина в оксигемоглобин, который будучи более сильной кислотой вытесняет углекислый газ из гидрокарбоната натрия.
Физиологические механизмы регуляции.
Буферная система крови нормализует pH после попадания избытка оснований или кислот в течение 30 с. Легким для этого требуется 1—2 мин. Участие легких в регуляции КОС заключается в прямом или рефлекторном изменении возбудимости дыхательного центра, в результате чего усиливается или ослабляется вентиляция легких и таким образом регулируется выделение углекислого газа, что эквивалентно контролю за удалением из организма ионов Н+.
Регуляторные системы, связанные с дыхательной функцией, играют важную роль в поддержании КОС, контролируя парциальное напряжение СO2 (РCO2) в артериальной крови. Показатель РCO2 характеризует парциальное напряжение углекислого газа над кровью. Как только образуется избыток углекислого газа, он захватывается эритроцитами и доставляется в легкие. Диоксид углерода взаимодействует с водой, т.е. подвергается гидратации с образованием угольной кислоты, которая затем диссоциирует на ионы водорода и бикарбоната:
![]() Эти реакции являются быстро обратимыми. В результате дегидратации угольной кислоты вновь образуются углекислый газ и вода. Реакции протекают медленнее, если они не катализируются.
Эти реакции являются быстро обратимыми. В результате дегидратации угольной кислоты вновь образуются углекислый газ и вода. Реакции протекают медленнее, если они не катализируются.
Фермент карбоангидраза находится в эритроцитах, клетках эпителия почечных канальцев, в других клетках и ускоряет эти реакции. Диссоциация угольной кислоты на ионы водорода и гидрокарбоната или обратная реакция возникает фактически немедленно. Пока скорость, с которой СO2 выводится из организма легкими, равна скорости, с которой она образуется, концентрация ионов Н+ не изменится.
Увеличение РСO2 ведет к высвобождению ионов Н+ и уменьшению pH. Это возникает, если снижена альвеолярная вентиляция, тогда углекислый газ. образованный вследствие метаболических процессов, накапливается в крови, концентрация угольной кислоты возрастает и pH крови снижается.
Снижение РСО2 наоборот, ведет к уменьшению содержания ионов водорода и, следовательно, к более щелочному значению pH. Причиной этого служит такое стимулирование легочной вентиляции, которое вызывает удаление углекислого газа, превосходящее его образование; РCO2: крови снижается и pH становится щелочным.
Следовательно, значительное изменение альвеолярной вентиляции глубоко влияет на pH крови. Физиологическое изменение легочной вентиляции не влияет на pH крови, так как буферные системы препятствуют сдвигу pH.
В норме альвеолярная вентиляция регулируется таким образом, чтобы изменения pH артериальной крови сводились бы к минимуму. Увеличение концентрации водородных ионов (снижение pH) в жидкостях организма. в артериальной крови и спинномозговой жидкости специфически ведет к рефлекторному увеличению частоты и глубины дыхания, в результате через легкие выделяется больше углекислого газа, концентрация ионов Н+ снижается и приближается к нормальной. Увеличение содержания нелетучей кислоты в крови может увеличить альвеолярную вентиляцию в 5 раз.
Избыток углекислоты в крови, например, из-за нарушения адекватного удаления углекислого газа (при усилении его образования или поступления в организм) сильно стимулирует вентиляцию, что увеличивает выделение углекислого газа и, таким образом, снижает накопление угольной кислоты в крови. Снижение концентрации ионов Н+ (повышение pH) в жидкостях организма угнетает дыхательную активность, что ведет к накоплению СO2 в крови, т.е. к гиперкапнии. Следовательно, уменьшение вентиляции при щелочных значениях pH обычно носит быстропроходящий характер, так как возникающая при этом гиперкапния стимулирует вентиляцию.
Гипоксия стимулирует дыхание, когда парциальное напряжение кислорода (РO2) в артериальной крови снижается до 80 мм рт. ст. и ниже. Возникающая гипервентиляция приводит к уменьшению РСО2 в артериальной крови, и при достижении критического уровня дыхание тормозится.
Таким образом, дыхательная система в норме так меняет свою активность, что изменения pH сводятся к минимуму. Дыхательная активность быстро реагирует на изменения КОС и нормализует pH крови в течение нескольких минут. Увеличение альвеолярной вентиляции в 2 раза по сравнению с нормальной может увеличить pH крови на 0,23. И наоборот, угнетение вентиляции только на 1/4 от нормального значения снижает pH на 0,4. Таким образом, легкие регулируют газообмен в организме, быстро ликвидируют опасность развития ацидоза или алкалоза.
Почечная регуляция концентрации ионов НСО3 плазмы.
Основной ролью почек в поддержании КОС является сохранение количества циркулирующего бикарбоната и выведение ионов водорода. Почки поддерживают щелочное значение pH внеклеточной жидкости путем увеличения экскреции с мочой ионов Н+ и сохранения бикарбонатов в плазме. Гидрокарбонат натрия реабсорбируется в почечных канальцах, что увеличивает щелочной резерв плазмы. В клетках почечного эпителия также происходит реакция углекислого газа с внутриклеточной водой с участием карбоангидразы. Образующаяся угольная кислота диссоциирует, ион Н+ активно секретиру-ется клеточной мембраной в просвет канальцев, а в клетки переходит эквивалентное иону водорода количество натрия, который поступает во внеклеточную жидкость и участвует в образовании бикарбоната. Почечный механизм регулирования концентрации ионов действует медленнее (в течение 10—20 ч), чем химические буферные системы или дыхательный механизм. Однако компенсация нарушений КОС является более полной из-за способности почек выводить ионы Н+, которые в большом количестве поступают из клеток в жидкости организма. Другие механизмы (химические, дыхательные) не могут выполнить функцию удаления ионов Н+ из внутренней среды.
Почечный контроль КОС включает три процесса, возникающих одновременно по длине нефрона:
- реабсорбция бикарбоната;
- экскреция титруемых кислот;
- экскреция солей аммония в виде хлорида и сульфата.
Все три механизма включают секрецию ионов Н+ в мочу и всасывание (возвращение) бикарбоната в плазму. Значительная роль в почках принадлежит фосфатному буферу, особенно образованию кислых фосфатов, в котором принимает участие и бикарбонатная система по следующей схеме:
Na2HP04 + Н2СO3 ↔ NaH2PO4 + NaHCO3
Образующийся гидрокарбонат натрия реабсорбируется, а кислый дигидрофосфат натрия выводится с мочой. Этот механизм также направлен на удаление ионов Н+ и экономию щелочных веществ для организма.
Реабсорбция фильтрованного бикарбоната является наиболее важным процессом в почечной регуляции КОС.
Установлено, что уменьшение pH крови тормозит реабсорбцию ионов Na+ в почечных канальцах, а увеличение pH вызывает обратный эффект. Таким образом, почки обеспечивают повышение или понижение содержания бикарбонатов в плазме крови в зависимости от изменения pH.
Ионы бикарбоната, образующиеся в клетках почечных канальцев, пассивно проходят через околотубулярную мембрану в кровь, сопровождая активно реабсорбируемые ионы NaH В моче ионы Н+ реагируют с ионами бикарбоната, образуя углекислоту, которая распадается на углекислый газ и воду. Вода или реабсорбируется с помощью осмотических механизмов, или выводится с мочой, в зависимости от состояния общего водного баланса организма. Углекислый газ и крови, и мочи находится в равновесии с углекислым газом в клетках почечных канальцев и обеспечивает основной стимул для образования бикарбоната в клетках.
Почки экскретируют ионы Н+ также в виде титруемых кислот, которые состоят в основном из Н2Р04, образованной из ионов НР042- и Н+ в почечных канальцах. Для каждого иона Н+, экскретируемого в виде титруемых кислот, эквивалентное количество гидрокарбоната натрия поступает в кровь. При обычной пище у человека с мочой экскретируется приблизительно от 10 до 20 нэкв титруемых кислот в сутки.
Около 40 нэкв в день ионов Н+ экскретируется в составе хлорида и сульфата аммония. При продолжительной нагрузке кислотой образование и экскреция аммония могут увеличиваться за несколько дней более чем в 10 раз. В клетках почечных канальцев экскреция осуществляется благодаря окислительному дезаминированию аминокислот, главным образом глутаминовой кислоты. Аммиак быстро растворяется в мембране, диффундирует из клеток почечных канальцев в их просвет, где образует с водородом ионы аммония (NH4+). Ионы аммония слабо проникают через клеточную мембрану и экскретируются с хлоридом в виде хлорида аммония NH4C1 и меньше — сульфата аммония (NH4)2SО4. В результате этих реакций соотношение концентраций ионов Н+ в моче и в крови достигает 1 :800. На каждый экскретируемый ион Н+ приходится эквивалентное количество натрия бикарбоната, поступающего в кровь. Выведение излишка ионов Н+ в обмен на ионы Na+ также сберегает этот дефицитный ион для организма. В норме почки секретируют свыше 40 мэкв НСО3 в сутки.
Роль печени.
Печень также активно участвует в регуляции КОС. В ней осуществляется нейтрализация кислот, в основном путем их дезаминирования. В орнитиновом циюте осуществляется синтез мочевины, на что используется аммиак, образующийся после дезаминирования аминокислот. В печени также происходит нейтрализация молочной кислоты, кетокислот и др.
При поступлении в организм избытка кислот в печени усиливается их нейтрализация и одновременно тормозится мочевинообразование. В результате этого неиспользованный аммиак нейтрализует кислоты и увеличивается выведение аммонийных солей с мочой. При защелачивании, наоборот, мочевинообразование увеличивается, аммониогенез ослабевает, что служит проявлением механизмов почечной компенсации при сдвигах КОС.
Роль поджелудочной железы.
Поджелудочная железа активно участвует в регуляции pH крови. Она секретирует большое количество ионов гидробикарбоната, что является ее уникальной и исключительно важной физиологической функцией.
Образование ионов гидрокарбоната тормозится при избытке кислот в межклеточной жидкости и усиливается при их недостатке.
Роль желудка.
В регуляции pH крови и тканей роль желудка заключается в торможении секреции соляной кислоты при защелачивании и усилении этого процесса при закислении. Этим желудок сохраняет для внутренней среды организма щелочные или кислые элементы в зависимости от сдвига КОС.
Интеграция механизмов поддержания КОС.
Как уже было сказано, механизмы зашиты организма от изменений pH состоят из химических буферов, а также дыхательных, почечных и других механизмов. Все они функционируют одновременно для поддержания pH в нормальных пределах и зависят друг от друга.
Нормальные пределы pH артериальной крови (7,35 — 7,45) сохраняются, когда соотношение бикарбоната к угольной кислоте составляет 20:1.
Концентрация угольной кислоты в плазме очень мала и не может быть измерена прямым путем. Но поскольку она пропорциональна концентрации растворенного углекислого газа, уровень концентрации угольной кислоты определяют расчетным способом. Установлено, что отношение бикарбоната к РCO2, определяет pH лучше, чем абсолютное количество бикарбоната и диоксида углерода. Такое соотношение называется соотношением Гендерсона— Гассельбаха: где рНарт кр — значение pH артериальной крови.
![]()
Бикарбонат плазмы регулируется в основном почками, тогда как парциальное напряжение РCO2 артериальной крови — легкими. Следовательно, эффективность, с которой действуют химические буферы, зависит от состояния дыхательных и почечных механизмов, поддерживающих собственные соотношения буферов. Поэтому легкие и почки иногда служат физиологическими буферами. Интеграция механизмов защиты от изменений pH отражена на рис. 10.3.
Иногда вместо определения количества ионов НСО3— по этому уравнению вычисляют общее содержание углекислого газа в плазме крови, которая представляет собой сумму бикарбонатов плазмы, растворенного углекислого газа и угольной кислоты. Последнюю измеряют путем окисления пробы плазмы после удаления всего углекислого газа.
В норме в плазме бикарбонаты составляют 95 % общего количества углекислого газа.